Среда, в которой распределены раздробленные частицы, носит название дисперсионной среды. Мелкие частицы, распределенные в дисперсионной среде, называют дисперсной фазой.
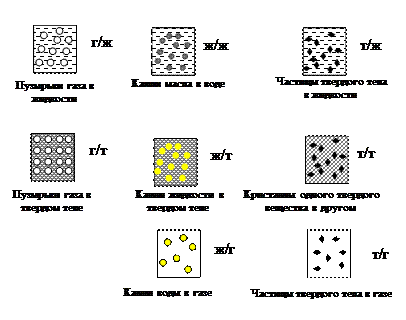
Рис. 11. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы (что) и дисперсионной среды (в чем)
Классификация дисперсных систем по размеру частиц дисперсной фазы представлена в табл. 1.
Таблица 1
Классификация дисперсных систем по размеру частиц
дисперсной фазы
| Тип системы | Размер частиц, м | Представители |
| Высокодисперсные (коллоидные растворы) | 10-9 - 10-7 | микрочастицы Au в воде (гидрозоль) |
| Среднедисперсные | 10-7 - 10-5 | сажа, пудра |
| Грубодисперсные | > 10-5 | цемент, туман |
Отступление. Жидкая вода состоит из молекул Н2О. Можно определить размер молекулы воды, если представить её сферической частицей радиуса r. Один моль воды содержит N = 6.02×1023 молекул (число Авогадро) и занимает объем VN = 18 см3. Следовательно, одна молекула занимает объем:
V = VN/N = 18/6.02×1023 » 3.0×10-23 см3.
Радиус сферической молекулы r вычисляется по уравнению:
V = 4/3 p r3 = 3.0×10-23 см3
r = 0.2×10-9 м.
Фактически радиус молекулы воды еще меньше, если принять во внимание незаполненное пространство между прижатыми друг к другу сферическими молекулами. Для образования в жидкой фазе кристаллов льда требуется не один десяток молекул воды. Таким образом, микрокристаллы воды (твердая фаза) должны иметь размеры порядка нескольких нанометров (1 нм = 10-9 м).
Высокодисперсные системы называют коллоидными растворами или золями.
Золь – высокодисперсная система с жидкой, газообразной или твердой дисперсионной средой и размером частиц дисперсной фазы 10-7 – 10-9 м, т.е. в 10 – 1000 раз больше, чем размеры атомов, молекул или ионов, если принять во внимание расчет, приведенный выше.
Золи с жидкой дисперсионной средой, например водой, называются гидрозолями. Частички золота (Au) в водном золе настолько малы, что участвуют в броуновском движении и практически не оседают на дно сосуда, образуя гидрозоль.
Если дисперсионной средой является газ, например воздух, дисперсная система называется аэрозолем. В помещении всегда присутствуют микрочастицы пыли (аэрозоль).
Отступление. Источником аэрозолей, опасных для человека, являются выхлопные газы автомобильного транспорта. Высокие концентрации твердых (сажи) и жидких частиц (органических веществ неполного сгорания дизельного топлива и бензина) в городском воздухе опасны тем, что в них содержатся такие канцерогены, как бенз(а)пирен. Это вещество является причиной раковых заболеваний.
Если выхлопные газы автомобилей еще как-то рассеиваются в атмосфере, то «выхлопные газы» сигареты или папиросы подведены прямо к легким курящего человека. Табачный дым – это дисперсная система Т/Г, содержащая обуглившиеся продукты сгорания табака. В них содержатся канцерогены и соединения кадмия, поражающие легкие, почки и надпочечники. Известно, что основным источником заболевания раком легких является курение. Легкие курильщика со временем становятся серыми вместо розовых, так как невозможно удалить твердые черные отложения табачного дыма из легких. Не случайно в США и европейских странах в общественных местах курение запрещено.
К золям с твердой дисперсионной средой относятся рубиновые стекла. В рубиновом стекле микрочастицы золота в ничтожных количествах (0.01 мас. %) распределены по всему объему предварительно расплавленного стекла.
Системы средней и грубой дисперсности отличаются от высокодисперсных систем более крупными частицами дисперсной фазы (табл. 1). К ним относятся эмульсии (Ж/Ж), суспензии и пасты (Т/Ж), пены (Г/Ж), сыпучие порошки (Т/Г) и твердые пены (Г/Т).
Эмульсии (Ж/Ж) – это грубодисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой. Наибольшее практическое применение имеют системы, в которых одной из фаз является вода (В), а другой – нерастворимая или плохо растворимая в воде органическая жидкость, которую условно называют маслом (М). Прямые эмульсии – это капли масла в воде (М/В), например молоко, а обратные эмульсии – капли воды в масле (В/М), например сливочное масло (рис. 12). Среди искусственных эмульсий назовем маргарин, лекарственные и косметические мази и кремы.
Суспензии (Т/Ж) – грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой. К таким системам относятся масляные краски (рис. 13, а), эмали, цветные лаки. Обычно они готовятся на растительных или синтетических маслах (дисперсионная среда), дисперсной фазой является твердый краситель.
 |
|
|


Рис. 12. Примеры: а) прямой (М/В) и б) обратной эмульсии (В/М)
Например, белую краску (титановые белила) готовят на основе оксида титана TiO2(т). В желтых и желто-бурых красках используются глинистые охры, содержащие Fe2O3(т), в синих – азурит 2CuCO3×Cu(OH)2(т).
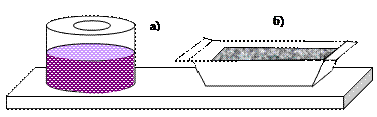 |
Рис. 13. Суспензии: а) краска; б) цементный раствор
К суспензиям относятся также свежеприготовленные цементные (рис. 13, б) и известковые «растворы». В строительстве принято суспензии называть растворами. Если цементный раствор хранить длительное время, то частички цемента оседают, и вверху появляется слой воды. Поэтому цементный раствор перевозят в специальных цементовозах, где он непрерывно перемешивается для стабилизации суспензии.
Пасты (Т/Ж) – концентрированные суспензии, например зубная паста содержит воду, твердые частички мела (СаСО3), и другие добавки, включая поверхностно-активные вещества (ПАВ).
Пена – грубодисперсная система с газовой дисперсной фазой и жидкой (Г/Ж) или твердой (Г/Т) дисперсионной средой (рис. 14).
Мыльная пена – это дисперсная система, где воздух является дисперсной фазой, а вода – дисперсионной средой. Пены с жидкой дисперсионной средой, как правило, неустойчивы, а с твердой дисперсионной средой могут существовать длительное время (пористая резина, пенополиуретан и др.). 
Рис. 14. Пена, образующаяся при работе пенного огнетушителя
Раздробленность приводит к резкому увеличению поверхности раздела между дисперсной фазой и дисперсионной средой. Для оценки межфазовой границы используют понятие удельной поверхности Sуд – поверхности раздела фаз S , отнесенной к единице массы дисперсной фазы или ее объему:
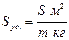 или
или 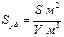
На рис. 15 показано, как измельчение твердого тела (раздробленность) приводит к резкому увеличению поверхности дисперсной фазы. Удельная поверхность левого большого куба объемом 1 м3 и ребром грани в 1 м составляет:
Sуд = 6 м2/1 м3 = 6 м-1
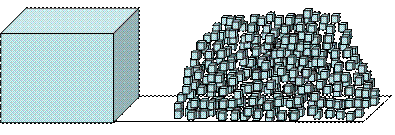 |
Рис. 15. Демонстрация того факта, как измельчение твердого тела приводит к увеличению поверхности раздела между фазами
Дробление куба на кубики с ребром грани l = 0.01 м приводит к тому, что удельная поверхность раздробленных частиц (дисперсной фазы) увеличивается в 600 раз:
Sуд = 6 (0.01)2 /(0.01)3 = 600 м-1
2.2. Поверхностное натяжение
Представим мысленно процесс падения кристаллического кубика льда с некоторой высоты (рис. 16). Если по мере падения лед плавится – происходит самопроизвольное изменение геометрической конфигурации тела. Лед превращается в каплю воды, имеющую форму шара. Объем льда и жидкой воды при фазовом переходе практически не меняется.
Известно, что из всех геометрических фигур наименьшую площадь имеет шар. Самопроизвольное изменение формы тела связано со стремлением системы перейти из неустойчивого в устойчивое состояние посредством сокращения площади поверхности.
Существенно ли изменяется площадь поверхности при превращении кубика льда в каплю жидкости? Представим, что ребро кубика а равно 1 см. Объем и поверхность такой фигуры соответственно равны 1 см3 и 6 см2. При превращении кубика льда в каплю жидкости объем не меняется, а площадь поверхности изменилась:
Vшар= Vкуб = 4p r3/3 = 1 см3,
r = 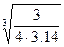 = 0.62 см,
= 0.62 см,
Sшар = 4p r2 или Sшар = 4×3.14×(0.62)2 = 4.83 см2
Произошло самопроизвольное сокращение поверхности тела с 6 см2 (лед в форме куба) до 4.83 см2 (капля воды). Причиной самопроизвольного сокращения поверхности является поверхностное натяжение.
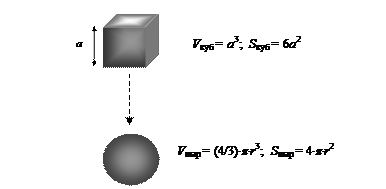
Рис. 16. Изменение геометрических параметров тела при самопроизвольном превращении кристалла льда (куб) в каплю воды (шар)
В глубине жидкости силы, действующие на молекулу со стороны окружения, взаимно компенсированы (рис. 17). Слой молекул, расположенный на границе раздела фаз (в данном случае на границе жидкость - газ) отличается особыми свойствами. Равнодействующая межмолекулярных сил притяжения каждой молекулы поверхностного слоя направлена вниз перпендикулярно поверхности жидкости. Для всех молекул поверхностного слоя нереализованная способность к взаимодействию со стороны газовой фазы количественно оценивается как энергия поверхностного слоя.
В самопроизвольном процессе термодинамическая система стремится перейти в устойчивое состояние. Критерием самопроизвольного процесса является уменьшение функции Гиббса при р,Т = const:
dG = s × ds < 0,
где s – поверхностное натяжение; ds – изменение поверхности раздела фаз.
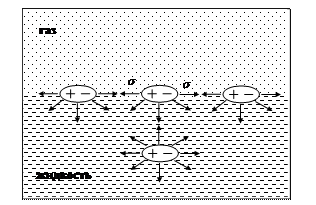 |
Рис. 17. Схема образования избыточной энергии межмолекулярного взаимодействия на поверхности раздела фаз (поверхностного натяжения)
Увеличение площади поверхности твердого или жидкого тела, т.е. дробление вещества на мелкие части, предполагает энергетические затраты на преодоление поверхностного натяжения. И наоборот, раздробленные тела стремятся сократить свою поверхность под действием энергии поверхностного натяжения. Отсюда следует, что поверхностное натяжение s - это энергия, затрачиваемая на изменение единицы поверхностной площади жидкого или твердого тела
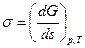 Дж/см2
Дж/см2
Поверхностное натяжение численно равно работе, которую необходимо совершить для изменения поверхности раздела фаз.
2.3. Процессы на границе раздела фаз
Любые раздробленные жидкие или твердые тела стремятся сократить свою поверхность под действием энергии поверхностного натяжения. Шарообразные частицы по сравнению с частицами другой формы обладают минимальной для данной массы вещества поверхностью и, следовательно, минимальной поверхностной энергией. Такую форму приобретают раздробленные до мелких частиц любые жидкости, например капли воды или капельки ртути (шары), мыльные пузыри (сферы). При контакте мелких капель происходит их слияние, так как система стремится к устойчивому состоянию (уменьшению функции Гиббса), сопровождающемуся уменьшением площади поверхности.
На рис. 18 представлены семь шарообразных ртутных капель радиусом 0.1 мм, которые в сумме имеют объем V1 = 0.03 мм3. Их общая площадь поверхности составляет S1 = 0.88 мм2.

Рис. 18. Самопроизвольное уменьшение поверхности раздела фаз, приводящее к снижению поверхностной энергии
При слиянии капель объем, занимаемый большой каплей, остается прежним, но площадь поверхности сокращается почти вдвое, до S2 = 0.46 мм2.
Адгезия
Адгезия – прилипание конденсированных тел разной природы контактирующими поверхностями.
Адгезия возможна в случае, когда между телами реализуется преимущественно ван-дер-ваальсово взаимодействие или водородные связи. Два тела прилипают при контакте поверхностями в результате уменьшения энергии поверхностного натяжения, присущего самопроизвольным, термодинамически разрешенным процессам.
Тело, которое прилипает, называют адгезивом. Тело, к которому прилипает адгезив, называется субстратом. Чаще всего субстратами являются разнообразные твердые тела (металлы, пластмассы, керамика, стекло, поверхность древесины и т.д.).
Один из видов адгезии представлен на рис. 19.
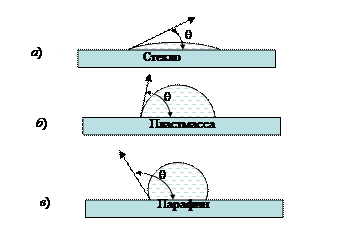 |
Рис. 19. Примеры различной адгезии: а) стекло - вода; б) стекло – полиэтилен; в) стекло – парафин
Адгезия воды к твердой поверхности уменьшается при переходе от стекла к пластмассе и парафину. Об этом можно судить по краевому углу смачивания q.
Стекло (аморфное твердое вещество) состоит из неупорядоченных цепочек силикатных тетраэдров с некоторым количеством ионов Na+ и Са2+. Полярный характер связей в стекле и молекулах воды обеспечивает эффективное взаимодействие в системе стекло – вода. Вода свободно растекается по поверхности стекла, покрывая его тонким слоем (рис. 19, а).
В состав органического полимерного материала, например полиэтилена или смеси высокомолекулярных углеводородов (парафин), входят неполярные молекулы, поэтому адгезия воды к таким поверхностям выражена слабо (рис. 19, б, в).
Лаки, краски, эмали обладают высокими адгезионными свойствами к различным по своей природе твердым материалам таким, как металлы, деревянные поверхности.
Адсорбция
Адсорбция – самопроизвольный процесс концентрирования вещества на границе раздела фаз. Адсорбентом является твердое тело или жидкость, на поверхности которого происходит концентрирование вещества. Если адсорбирующееся вещество находится над поверхностью в объеме, оно называется адсорбтивом, а если закрепилось на поверхности адсорбента – адсорбатом.
Рассмотрим физическую адсорбцию вещества Х на твердой поверхности s.
Х + s ⇄ Х s
адсорбтив адсорбент адсорбционный комплекс
Физическая адсорбция происходит в результате действия сил межмолекулярного взаимодействия (сил Ван-дер-Ваальса или водородных связей).
Молекулы, входящие в состав адсорбата и адсорбента, участвуют в ориентационном взаимодействии, если являются диполями:
 |
 Возможно индукционное взаимодействие, если молекулы, входящие в состав адсорбата и адсорбента различаются степенью полярности. Например, молекулы адсорбента – диполи, а адсорбат представлен неполярными молекулами. При сближении молекулы адсорбата превращаются в наведенные диполи:
Возможно индукционное взаимодействие, если молекулы, входящие в состав адсорбата и адсорбента различаются степенью полярности. Например, молекулы адсорбента – диполи, а адсорбат представлен неполярными молекулами. При сближении молекулы адсорбата превращаются в наведенные диполи:
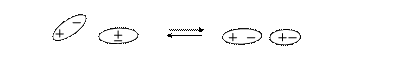 |
Притяжение между молекулами адсорбента и адсорбата возникает на близких расстояниях, если молекулы, входящие в состав адсорбата и адсорбента не являются диполями. Между ними реализуется дисперсионное взаимодействие (притяжение двух наведенных диполей):

Наряду с концентрированием молекул Х (адсорбата) на поверхности адсорбента (адсорбция) происходит и обратный процесс – десорбция. При десорбции молекулы, адсорбированные на поверхности, снова переходят в объем (рис. 20).
 | |||||
| |||||
| |||||
Рис. 20. Модель физической (обратимой) адсорбции и десорбции на границе раздела фаз твердое тело – газ
Адсорбция компонента Х на указанных поверхностях раздела фаз описывается фундаментальным уравнением адсорбции Гиббса, выведенным на основании второго закона термодинамики:
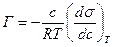 ,
,
где Г – количество адсорбированного вещества [моль/см2]; с – концентрация адсорбтива Х [моль/л]; R – газовая постоянная [8.314 Дж/(моль×К)]; s – поверхностное натяжение [Дж/см2].
Для описания адсорбции вещества Х на границе твердое тело – газ часто используется уравнение Ленгмюра:
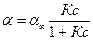 ,
,
где a - количество адсорбированных частиц; a¥ - предельное количество адсорбированных частиц, которое может быть достигнуто при р,Т = const; К – константа адсорбционного равновесия; с – концентрация адсорбтива
Отступление. Вывод уравнения Ленгмюра опирается на следующие положения:
1) адсорбция происходит не на всей поверхности твердого тела, а на определенных участках – адсорбционных центрах;
2) адсорбционный центр удерживает только одну молекулу (мономолекулярная адсорбция);
3) адсорбция и десорбция свидетельствуют о динамическом процесе. При достижении состояния равновесия скорость адсорбции uадс. равна скорости десорбции uдес..
Пусть число адсорбционных центров на поверхности твердого адсорбента равно a¥. Из них a - занято адсорбатом. Тогда число свободных адсорбционных центров равно (a¥. – a). В соответствии с законом действующих масс:
uадс = kадс.×c (a¥. – a),
uдес. = kдес.×a.
В состоянии динамического равновесия uадс = uдес или
kадс.×c (a¥. – a)= kдес.×a.
Получаем уравнение Ленгмюра:
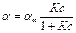 , где К = kадс./kдес.
, где К = kадс./kдес.
Динамическое равновесие устанавливается, когда поверхность адсорбента заполнена до насыщения. Дальнейшее увеличение концентрации адсорбируемого вещества в газовой смеси не изменит концентрацию молекул адсорбата на единице поверхности адсорбента (рис. 21).
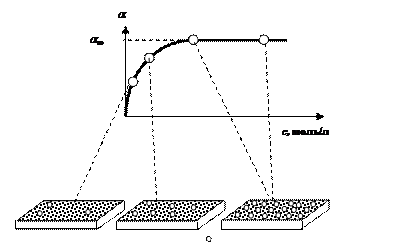 |
Рис. 21. Изотерма (Т = const) мономолекулярной адсорбции на твердом адсорбенте
При химической адсорбции (хемосорбции) молекулы адсорбата реагируют с поверхностным слоем адсорбента. Образуется химическое соединение, закрепленное на поверхности адсорбента, поэтому хемосорбцию следует рассматривать как необратимую химическую реакцию на поверхности раздела фаз.
Отступление. Адсорбция относится к одному из важнейших и широко распространенных поверхностных явлений, используемых в промышленности.
Очистка атмосферного воздуха основана на адсорбции паров, газов и фильтрации частиц аэрозоля в системе твердое тело – газ. Такую функцию выполняет фильтрующий противогаз (рис. 22).
В противогазной коробке находятся две основные части, обеспечивающие очистку вдыхаемого воздуха: противоаэрозольный фильтр и адсорбент. Противоаэрозольный фильтр изготовлен на основе волокон целлюлозы, синтетических материалов и других компонентов, способных задерживать частицы аэрозоля за счет адгезии. Функцию адсорбента выполняет активированный уголь с каталитическими и хемосорбционными добавками (оксидами металлов), необратимо связывающими вредные вещества.
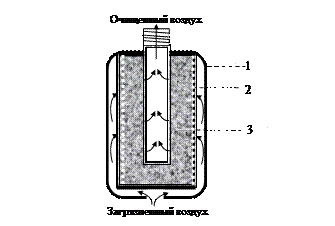
Рис. 22. Коробка противогаза (1) и её основные фильтрующие части: 2 – противоаэрозольный фильтр; 3 – адсорбент
На поверхности активированного угля хорошо адсорбируются газы, имеющие относительно высокие температуры кипения. К таким газам относится, например Cl2 (Ткип. = - 33.5 оС). Не адсорбируются газы, имеющие низкие по сравнению, например, с хлором температуры кипения, например азот N2 (Ткип. = - 196 оС) и кислород О2 (Ткип. = - 183 оС) воздуха, которые беспрепятственно проходят через коробку противогаза. Если в зоне пожара накапливается много оксида углерода (II) CO (Ткип. = - 190 оС), приходится использовать специальный противогаз, адсорбенты которого необратимо связывают СО, за счет хемосорбции.
Активированный уголь используется в пищевой промышленности в качестве адсорбента для очистки сахарного сиропа от красящих веществ и очистки растительного масла от примесей жирных кислот.
2.4. Поверхностно-активные вещества
Химические соединения, адсорбция которых на границе раздела фаз приводит к изменению поверхностного натяжения, называются поверхностно-активными веществами (ПАВ). Поверхностная активность таких соединений объясняется строением молекул (рис. 23).
|
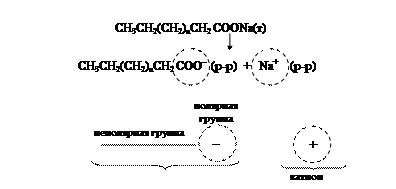
Рис. 23. Модель молекулы соли жирной кислоты (мыло) и диссоциация соли в воде
Соли таких органических кислот, как стеарат натрия С17Н35СООNa, олеат натрия С17Н33СООNa содержат длинную неполярную углеводородную цепь и небольшую по размеру полярную группу –СООNa
В жидкой среде молекулы поверхностно-активного вещества «обманывают» полярные молекулы воды, разворачиваясь к ним полярными группами (рис. 24, а). Формируются сферические молекулярные образования – мицеллы. Неполярные группы входят внутрь органического ядра мицеллы.
Мицеллы – высокодисперсные частицы, сформированные в жидкой дисперсионной среде из молекул поверхностно-активного вещества. Мицеллы не слипаются, т.к. имеют одинаковый по знаку заряд.
Молекулы воды вытесняют некоторую часть ПАВ на границу, разделяющую фазы вода – воздух (рис. 24, б).
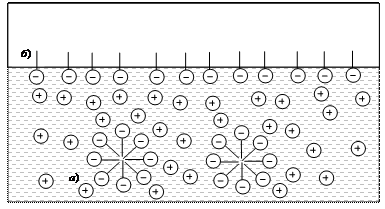 |
Рис. 24. Адсорбция поверхностно-активного вещества на границе вода – воздух и образование мицеллярного раствора
Полярные группы анионов жирных кислот остаются в водной среде, неполярные – в газовой фазе. Так концентрируется молекулярный слой адсорбированных молекул ПАВ на границе раздела фаз
Концентрация ПАВ на поверхности раздела фаз вода – воздух уменьшает поверхностное натяжение до низких значений, характерных для углеводородов.
Свойство ПАВ концентрироваться на границе раздела фаз масло – вода используется при очистке поверхностей от масляных пятен (рис. 25).
Молекулы мыла концентрируются на поверхности раздела фаз вода – масло (рис. 25, а), причем неполярные концы ПАВ обращены в сторону жирного пятна.
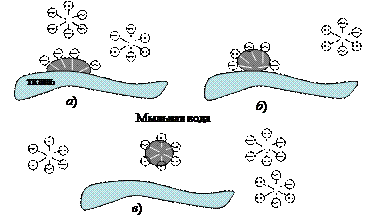 |
Рис. 25. Модель очистки ткани от жирных пятен (стирка)
По мере интенсивного движения ткани в стиральной машине или при ручной стирке пятно окружается со всех сторон молекулами ПАВ (рис. 25, б) и уходит с поверхности ткани в мыльный раствор (рис. 25, в). Без ПАВ жирное пятно осталось бы на поверхности ткани, так как органические вещества не растворимы или плохо растворимы в воде.
Кроме мыла существуют разнообразные ПАВ, например производные алкилсульфокислот СН3(СН)nCH2SO3Na, алкилбензолсульфокислот СН3(СН)nCH2С6Н4SO3Na и другие поверхностно-активные вещества, широко использующиеся в быту и промышленных процессах.
Отступление. Примерно половина производимых промышленностью поверхностно-активных веществ используется для получения моющих (мыла) и чистящих средств.
Мыло может быть твердым СН3СН2(СН2)nCН2 СООNa (т) и жидким СН3СН2(СН2)nCН2СООК(ж). В шампунях используются алкилсульфокислоты СН3(СН)nCH2SO3Na, содержащие 12 – 14 углеродных атомов в углеводородной цепи.
В стиральных порошках используются алкилбензолсульфокислоты в композиции с солями угольной (NaHCO3, Na2CO3) и серной кислот (Na2SO4), ароматизаторами, флокулянтами. Последние представляют собой полимерные соединения, которые при растворении в воде образуют рыхлые хлопья. Они захватывают частицы грязи в составе мицелл и не дают им осесть на поверхности отстиранных тканей.
При вращательном бурении газовых и нефтяных скважин используются буровые насосы, предназначенные для прокачивания воды и глинистых растворов, обеспечивающих циркуляцию промывочной жидкости в скважине. Для регулирования агрегативной устойчивости глинистых растворов, поступающих в скважину, применяют добавки высокомолекулярных ПАВ – водорастворимых эфиров целлюлозы, а также кальциевых солей природных и жирных синтетических кислот и алкилароматических сульфонатов.
В эмульсионной полимеризации (получение полистирола и других виниловых полимеров) используются добавки солей синтетических жирных кислот СН3(СН)nCH2COONa и алкилсульфонатов СН3(СН)nCH2SO3Na.
При механической обработке металлов и повышении скорости резания, строгания, фрезерования также используются ПАВ, главным образом водные растворы мыла.
2.5. Наночастицы
Среди дисперсных систем особое внимание в настоящее время сосредоточено на частицах твердой фазы, имеющих наноразмеры 1 – 10 нм (1 нанометр = 10-9 м). Наночастицы, диаметр которых меньше 10 нм, приближаются к размерам отдельных атомов и молекул. Квантовомеханические расчеты, выполненные Дж. Уэбером и Д. Кромером, показывают, что орбитальные радиусы атомов лежат в пределах от 0.029 нм (радиус атома гелия) до 0.245 нм (радиус атома цезия).
Доля атомов на поверхности наночастицы сопоставима с количеством атомов в объеме. Не все химические связи реализуются в атомах, расположенных на поверхности наночастицы. В связи с этим атомы поверхностного слоя становятся активными реагентами и взаимодействуют практически с любыми химическими соединениями.
Высокая реакционная способность и уникальные физические свойства отличают наночастицы от макрочастиц. Например, резко изменяется температура плавления нанокристаллов (размером 5 – 10 нм) по сравнению с макрокристаллом.
Существуют разнообразные способы получения наночастиц. Например, один из них основан на испарении материала (металла, неметалла) при низком давлении в среде инертного газа с помощью лазерного, электронно-лучевого и др. источника энергии. При высокой температуре вещество испаряется. Образовавшийся пар конденсируется в виде наночастиц на охлаждаемой поверхности. Требуется принимать меры к тому, чтобы избежать слипания наночастиц в силу их высокой реакционной способности.
На основе наночастиц созданы и создаются материалы, обладающие уникальными электрофизическими, механическими, оптическими свойствами. Практические результаты налицо. В США уже производятся «пассивные наноструктуры» - нанопорошки, которые добавляются в полимеры, керамику, металлы, покрытия, лекарства, косметику, пищу и прочие товары народного потребления (всего несколько сот видов товаров). Например, производятся непахнущие синтетические носки с частицами наносеребра (серебро - антисептик), непромокаемые брюки и плащи. Для автомобильных стартеров удалось изготовить пластмассу, которая проводит электрический ток лучше, чем медь.
Сегодня 60% американских автомобилей оснащены бензопроводами, содержащими углеродные нанотрубки. За счет высокой электропроводности они нейтрализуют статические заряды, которые могут породить искру, особенно опасную, если топливо просочиться через нейлоновый материал бензопровода. В автомобилях «Рено Клио», «Меган» нанотрубками наполнены пластиковые крылья.
Краткий итог темы
1. Гетерогенные смеси веществ образуют дисперсные системы, состоящие из двух или более фаз с развитой поверхностью раздела между ними. Одна из фаз образует непрерывную дисперсионную среду, в которой распределена дисперсная фаза в виде мелких частиц.
2. Высокодисперсные системы (золи) и системы средней и грубой дисперсности отличаются размером частиц дисперсной фазы и величиной поверхностной энергии.
3. Повышенная поверхностная энергия дисперсных систем приводит к проявлению поверхностных явлений. Любое раздробленное жидкое или твердое тело стремится сократить свою поверхность под действием поверхностного натяжения – энергии, затрачиваемой на изменение единицы поверхностной площади жидкого или твердого тела. Процесс слияния капель и слипания твердых частиц является самопроизвольным, так как дисперсная система стремится перейти в устойчивое состояние, сопровождающееся уменьшением функции Гиббса (dG < 0)
4. Повышенная поверхностная энергия приводит к появлению адгезии (прилипанию). Между молекулами (атомами, ионами), расположенными на двух соприкасающихся поверхностях твердое тело – твердое тело или твердое тело – жидкость, силы электромагнитного притяжения (силы Ван-дер-Ваальса) удерживают соприкасающиеся поверхности.
5. Концентрирование вещества на границе раздела фаз (адсорбция) твердое тело – жидкость, твердое тело – газ, жидкость – газ обусловлено физическим или химическим взаимодействием молекул адсорбата с молекулами адсорбента, расположенными на поверхности.
6. На границе поверхности раздела фаз масло – вода и вода – газ происходит концентрирование поверхностно-активных веществ (ПАВ) из водного раствора. Поверхностно-активные вещества имеют особое строение молекул. Они содержат длинные неполярные углеводородные радикалы, соединенные с небольшими по размеру полярными группами. ПАВ понижают поверхностное натяжение, стабилизируют дисперсные системы. Они широко используются в быту (стирка), косметике, медицине, бурении нефтяных и газовых скважин и других сферах практической деятельности человека.
Термины для запоминания
Адгезия , или прилипание, относится к процессу притяжения (электромагнитного взаимодействия) между молекулами (атомами, ионами), расположенными на двух соприкасающихся поверхностях твердое тело – твердое тело или твердое тело – жидкость.
Адсорбция – процесс концентрирования вещества на границе раздела фаз.
Адсорбентом называют твердое тело или жидкость, на поверхности которого концентрируются молекулы вещества из газовой или жидкой фазы.
Адсорбат – молекулы вещества на поверхности адсорбента.
Адсорбтив – молекулы вещества в объеме жидкой или газовой фазы.








