Скорость гомогенной химической реакции определяется изменением концентрации реагента или продукта реакции во времени.
Сложная реакция складывается из нескольких разнотипных простых реакций.
Теория соударений выделяет три условия, выполнение которых обеспечивает химическое превращение реагентов.
Химическая кинетика – раздел физической химии, изучающий скорость и механизм химических процессов.
Цепная реакция – процесс, в котором превращение исходных веществ в продукты осуществляется путем многократного чередования элементарных актов с участием свободных радикалов и атомов.
Элементарный химический акт – столкновение микрочастиц, результатом которого является химическое превращение, совершающееся в один акт, в одно действие.
Вопросы для проверки знаний
1. В чем различие между простой и сложной реакцией?
2. Чем похожи простая и элементарная реакции?
3. Согласны ли вы с утверждением, что порядок и молекулярность сложной реакции совпадают?
4. Согласны ли вы с утверждением, что скорость реакции соответствует изменению массы реагента в единицу времени?
5. Объясните, почему скорость реакции прямо пропорциональна произведению концентраций, а не сумме концентраций реагирующих веществ?
6. Дайте определение каталитической реакции.
7. Какой из факторов с позиции теории активированного комплекса изменяет катализатор?
8. Изменяет ли катализатор константу химического равновесия?
Упражнения
1. Реакция между водородом и йодом H2 + I2 ⇄ 2HI является сложной и осуществляется при участии двух элементарных реакций
I2 ⇄ 2 I (быстро); 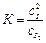 (константа равновесия)
(константа равновесия)
Н2 + 2 I → 2 HI (медленно); 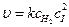 .
.
Докажите, что скорость сложной реакции между водородом и йодом подчиняется уравнению реакции второго порядка 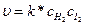 .
.
2. Во сколько раз возрастет скорость простой реакции
А + 2В → продукты реакции,
если концентрацию реагента А увеличили в 2 раза, а концентрацию реагента В в 4 раза?
3. Для простой необратимой реакции первого порядка
А → В
концентрация реагента А изменяется со временем следующим образом:
| t, мин | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| сА, моль/л | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 | 0.0125 | 0.0062 |
| сВ, моль/л |
Вставьте в таблицу численные значения концентрации продукта В за этот отрезок времени.
4. Для простой необратимой реакции первого порядка А → 2В
концентрация реагента А изменяется со временем следующим образом:
| t, мин | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| сА, моль/л | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 | 0.0125 | 0.0062 |
| сВ, моль/л |
Вставьте в таблицу численные значения концентрации продукта В за этот отрезок времени.
П р и л о ж е н и е
Энтальпии образования и абсолютные значения энтропии
некоторых простых и сложных веществ
| № | Вещество | Df H0298, кДж/моль | S0298, Дж/моль К |
| I Простые вещества | |||
| 1 | С (кр.) алмаз | 1,897 | 2,38 |
| 2 | С (кр.) графит | 0 | 5,74 |
| 3 | Са -a(кр.) | 0 | 41,62 |
| 4 | F2 (г.) | 0 | 202,9 |
| 5 | Fe -a(кр.) | 0 | 27,15 |
| 6 | H (г.) | 217,9 | 114,6 |
| 7 | H2 (г.) | 0 | 130,6 |
| 8 | N2 (г.) | 0 | 191,5 |
| 9 | O (г.) | 247,4 | 160,95 |
| 10 | O2 (г.) | 0 | 205,03 |
| 11 | O3 (г.) | 142,3 | 238,8 |
| 12 | S (монокл.) | 0,30 | 32,55 |
| 13 | S (ромбич.) | 0 | 31,88 |
| II Неорганические соединения | |||
| 14 | СО (г.) | -110,5 | 197,4 |
| 15 | СО2 (г.) | -393,51 | 213,6 |
| 16 | CaCO3 (кр.) кальцит | -1206 | 92,9 |
| 17 | CaO (кр.) | -635,1 | 39,7 |
| 18 | Са(ОН)2 (кр.) | -986,2 | 83,4 |
| 19 | FeO (кр.) | -263,68 | 58,79 |
| 20 | Fe2O3 (кр.) | -821,32 | 89,96 |
| 21 | FeS2 (кр.) | -177,40 | 53,14 |
| 22 | HF (г.) | -268,61 | 173,51 |
| 23 | H2O (г.) | -241,84 | 188,74 |
| 24 | H2O (ж.) | -285,84 | 69,96 |
| 25 | H2O (кр.) | -291,85 | 39,33 |
| 26 | H2S (г.) | -20,15 | 205,64 |
| 27 | NH3 (г.) | -46,19 | 192,50 |
| 28 | NO (г.) | -90,37 | 210,62 |
| 29 | NO2 (г.) | -33,89 | 240,45 |
| 30 | Na2SiO3 (кр.) | -1518 | 113,8 |
| 31 | Na2Si2O5 (кр.) | -2398 | 164,8 |
| 32 | SO2 (г.) | -296,9 | 248,1 |
| 33 | SO3 (г.) | -395,2 | 256,23 |
| 34 | SiO2 (кварц-a) | -859,3 | 42,09 |
| III Органические соединения (углеводороды) | |||
| 35 | СН4 (г.) метан | -74,85 | 186,19 |
| 36 | С2Н6 (г.) этан | -84,67 | 229,5 |
| 37 | С2Н4 (г.) этилен | 52,28 | 219,4 |
| 38 | С2Н2(г.) ацетилен | 226,75 | 200,8 |
| 39 | н-С4Н10(г.) бутан | -124,7 | 310,0 |
| 40 | С6Н6 (г.) бензол | 82,93 | 269,2 |
| 41 | С6Н6 (ж.) бензол | 49,04 | 173,2 |
| 42 | С6Н12(г.) циклогексан | -123,1 | 298,2 |
| 43 | н-С6Н14(г.) н-гексан | -167,19 | 386,8 |
| 44 | н-С6Н14(ж.) н-гексан | -198,8 | 296,0 |
| 45 | С7Н8(ж.) толуол | 50,00 | 319,7 |
| 46 | С7Н8(г.) толуол | 8,08 | 219 |
| 47 | н-С7Н16(г.) н-гептан | -187,82 | 425,3 |
| 48 | н-С8Н18(г.) н-октан | -208,4 | 463,7 |
| Кислородсодержащие соединения | |||
| 49 | СН4О(г.) метанол | -201,2 | 239,7 |
| 50 | СН4О(ж.) метанол | -238,7 | 126,7 |
| 51 | С2Н6О(г.) этанол | -235,3 | 282,0 |
| 52 | С2Н6О(ж.) этанол | -277,6 | 160,7 |
| 53 | С2Н4О2(г.) уксусная кислота | -437,4 | 282,5 |
| 54 | С2Н4О2(ж.) уксусная кислота | -484,9 | 159,8 |
| 55 | С3Н8О3(ж.) глицерин | -659,4 | 207,9 |
| 56 | С12Н22О11(кр.) сахароза | -2221 | 360 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная
1. Глинка, Н.Л. Общая химия: учебн. пособие. /Под ред. В.А. Рабинович. – Л.: Химия, 1985. – 704 с.
2. Вольхин, В. В. Общая химия. Основной курс: учебн. пособие, 2-е изд., перераб. и доп. /В. В. Вольхин. – СПб.: Лань, 2008. – 464 с.
3. Еремин, Е. Н. Основы химической кинетики в газах и растворах /Е. Н. Еремин. – М.: МГУ, 1971. – 384 с.
4. Карякин, Н. В. Основы химической термодинамики: учебн. пособие для вузов /Н. В. Карякин. – М.: Изд. центр «Академия», 2003. – 464 с.
5. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов /Ю.А. Ершов, В. А. Попков, А. С. Берлянд и др.; под ред. Ю. А. Ершова. – 2-е изд., испр. и доп. – М.: Высш шк., 2000. – 560 с.
6. Глинка, Н.Л. Задачи и упражнения по общей химии /под ред. В.А. Рабинович. – М.: Интеграл – Пресс, 2003. – 240 с.
Дополнительная
1. Вольхин, В. В. Общая химия. Избранные главы: учебн. пособие, 2-е изд., перераб. и доп. /В. В. Вольхин. – СПб.: Лань, 2008. – 384 с.
2. Вольхин, В. В. Общая химия. Специальный курс: учебн. пособие, 2-е изд., перераб. и доп. /В. В. Вольхин. – СПб.: Лань, 2008. – 448 с.
3. Коровин, Н.В. Общая химия. / Н.В. Коровин. – М.: Высш. шк., 2003. – 557 с.
4. Байрамов, Р.М. Химическая кинетика и катализ /Р.М. Байрамов. М.: Изд. центр «Академия», 2003. – 320 с.
5. Бажин, Н.М. Термодинамика для химиков / Н.М. Бажин. – М.: Изд. центр «Академия», 2004. – 416 с.
СОДЕРЖАНИЕ
Введение……………………………………………………………….3
Тема 1. Атомный уровень организации вещества…………………..5
1.1. Модели атомов………………………………………...5
1.2. Взаимодействия в атомах……………………………10
1.3. Свойства атомов……………………………………...13
1.4. Периодический закон Д.И. Менделеева.
Квантовые законы…………………………………...14
Краткий итог темы………………………………………...22
Термины для запоминания………………………………..23
Вопросы для проверки знаний…………………………....25
Упражнения……………………………………………..…25
Тема 2. Молекулярный уровень организации вещества.
Кристаллы с ионной и металлической связью...………..…27
2.1. Модели молекул. Ковалентная химическая связь…..28
2.2. Гибридизация, s- и p-связи…………………………..30
2.3. Донорно-акцепторная связь…………………………..34
2.4. Ионная связь…………………………………………...35
2.5. Металлическая связь…………………………………..38
2.6. Квантовые правила образования химической связи...39
Краткий итог темы………………………………………....43
Термины для запоминания………………………………...44
Вопросы для проверки знаний………………………….....46
Упражнения……………………………………………..….46
Тема 3. Твердые вещества, жидкости, газы………………………….48
3.1. Модели кристаллических и аморфных веществ…….48
Кристаллы…………………………………………….49
Аморфные тела……………………………………….53
Жидкие кристаллы……………………………………54
3.2. Жидкости и газы……………………………………….56
3.3. Взаимодействия в макросистемах……………………58
Водородная связь……………………………………..59
Краткий итог темы………………………………………....62
Термины для запоминания………………………………...63
Вопросы для проверки знаний………………………….....64
Упражнения……………………………………………..….64
Тема 4. Термодинамические свойства макросистем.
Законы термодинамики……………………………………...66
4.1. Закон термического равновесия………………..…….67
4.2. Первый закон термодинамики………………………..70
4.3. Свойства термодинамических систем………………..73
Внутренняя энергия…………………………………74
Теплота……………………………………………….75
Теплоемкость………………………………………...77
Работа…………………………………………………79
4.4. Применение первого закона термодинамики
к химическим процессам……………………………...84
Термохимические расчеты………………………….85
4.5. Второй закон термодинамики…………………………90
Энтропия……………………………………………..91
Функция Гиббса……………………………………..94
Приближенное вычисление функции Гиббса
Третий закон термодинамики………………………97
4.6. Термодинамический взгляд на химическое
равновесие. Химический потенциал
индивидуального вещества…………………………...100
Общее условие химического равновесия………….101
Влияние температуры на смещение
химического равновесия………………. 105
Влияние концентрации участников реакции
на смещение химического равновесия…. . 107
Краткий итог темы……………………………………….....109
Термины для запоминания…………………………………110
Вопросы для проверки знаний…………………………......113
Упражнения……………………………………………..…...113
Тема 5. Скорость и механизм химической реакции………………….115
5.1. Кинетика химических процессов……………………...115
Механизм реакции…………………………………..116
Скорость реакции…………………………………...120
Теория столкновений. Закон действия масс………121
Теория активного комплекса……………………….125
Каталитические реакции……………………………126
Молекулярность и порядок реакции……………….129
Реакции первого порядка…………………………...133
Краткий итог темы……………………………………….....136
Термины для запоминания………………………………....137
Вопросы для проверки знаний…………………………......140
Упражнения……………………………………………..…..140
Приложение…………………………………………………142
Список рекомендуемой литературы……………………… 144








