Инициирование или зарождение цепи – реакция образования активных частиц, атомов и радикалов из молекул.
Катализатор – вещество, участвующее в химических превращениях и увеличивающее скорость реакции, но после завершения процесса остающееся в неизменном состоянии и количестве.
Каталитической называется реакция, скорость которой возрастает при введении катализатора.
Механизм химической реакции есть совокупность последовательно и параллельно протекающих элементарных химических актов, обеспечивающих превращение исходных веществ в конечные продукты.
Молекулярность реакции определяется числом частиц (атомов, молекул, ионов, радикалов), участвующих в элементарном акте.
Н× + О2 ® НО× + ×О×
Н× + О2 ® НО× + ×О×
Н2 + ×О×® НО× + Н×
Н2 + О2 ® Н× + НОО×
Необратимая реакция – это реакция количественного превращения исходных веществ в продукты.
НО× + ×Н + М ® Н2О + М*
НО× + Н2® Н2О + Н.×
Обрыв цепи – гибель атома или радикала в результате реакции между ними.
Общий порядок реакции равен сумме показателей степеней концентраций всех реагентов, которые входят в кинетическое уравнение скорости реакции. Например, для простой бимолекулярной реакции общий порядок равен двум: nA + nB.= 1 + 1 = 2.
Основной закон химической кинетики (закон действия масс) утверждает, что скорость простой реакции в каждый момент времени прямо пропорциональна произведению концентраций реагирующих веществ.
Период полураспада t 1/2 – время, за которое превращается половина исходного реагента.
Порядок реакции по данному реагенту – это показатель степени ni , с которым концентрация реагента входит в уравнение скорости реакции.
Правило Вант-Гоффа утверждает: при увеличении температуры на 10 0С скорость реакции увеличивается в 2 – 4 раза.
Продолжение цепи – реакция атомов и радикалов с молекулами исходных веществ с образованием продуктов реакции и сохранением атомов и радикалов.
Простая реакция состоит из одних и тех же элементарных химических актов.
Разветвление цепи – образование нескольких активных частиц (атомов и радикалов) из одной активной частицы (атома или радикала).
Сванте Аррениус эмпирически установил зависимость константы скорости химической реакции k от температуры k = k 0 × 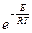 , где k 0 – предэкспоненциальный множитель, Е – энергия активации реакции.
, где k 0 – предэкспоненциальный множитель, Е – энергия активации реакции.








