Реакции первого порядка
Рассмотрим применение основного закона кинетики к простым односторонним (необратимым) реакциям.
Для реакции первого порядка
А ® продукты реакции
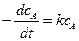 .
.
Разделим переменные и интегрируем уравнение в пределах от начальной концентрации сА = с0 (при t = 0) до сА = с, соответствующей моменту времени t .
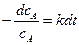 ,
,
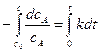 ,
,
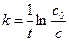 . (5.12)
. (5.12)
Введем понятие период полураспада t 1/2 – время, за которое превращается половина исходного реагента. К моменту времени t 1/2 концентрация исходного вещества А уменьшается наполовину сА = с0/2. Подставим в уравнение (5.12) время, соответствующее периоду полураспада вещества А:
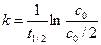 ,
,
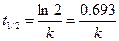 . (5.13)
. (5.13)
Как видно, период полураспада мономолекулярной реакции не зависит от концентрации реагирующего вещества и определяется значением константы скорости реакции. За промежуток времени, равный периоду полураспада, превращается половина текущей концентрации реагента (рис. 55).
Если t1/2 вещества А равен 5 мин, то при любой концентрации вещества А за отрезок времени, равный 5 мин, эта концентрация уменьшится вдвое.
Воспользовавшись уравнением (5.12), представим зависимость текущей концентрации реагента А от времени
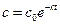 . (5.14)
. (5.14)
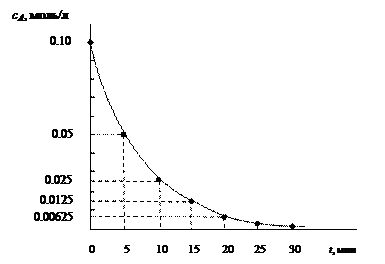
Рис. 55. График изменения концентрации вещества А от времени реакции
Пример. Классическим процессом, подчиняющимся уравнению реакции первого порядка, является радиоактивный распад. Например, известно, что радиоактивный йод 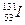 распадается с выделением из ядра атома электрона (b-распад) и образованием инертного газа – ксенона-131:
распадается с выделением из ядра атома электрона (b-распад) и образованием инертного газа – ксенона-131:
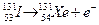
Период полураспада йода-131 равен 8.06 дня. Вычислим время, которое потребуется, чтобы относительное содержание иода-131, оказавшееся в щитовидной железе человека, уменьшилось в 1000 раз.
Решение. Вычислим константу скорости радиоактивного распада по уравнению (5.13):
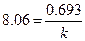 ,
,
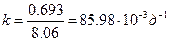 .
.
Подставим значение константы скорости превращения радиоактивного иода-131 в уравнение (5.12)
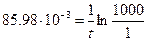 ,
,
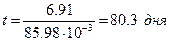
В течение 80 дней человек, в щитовидную железу которого попал радиоактивный йод-131, подвергается опасному облучению, прежде чем концентрация его уменьшится в 1000 раз.
Краткий итог темы
1. Все химические процессы протекают в пространстве и во времени. Под пространством подразумевается объем, занимаемый реагентами. Время реакции зависит от скорости превращения исходных веществ в продукты реакции.
2. Следует различать сложные реакции (совокупность последовательно и параллельно протекающих простых реакций) и простые реакции, идущие в один акт, в одно действие.
3. Знание механизма реакции позволяет определить, какая элементарная реакция является наиболее медленной, подобрать условия, изменяющие её скорость, и, следовательно, скорость реакции в целом.
4. Теория соударений выделяет три условия, выполнение которых обеспечивает химическое превращение реагентов:
1) столкновение реагентов;
2) столкновение с энергией активации Е;
3) столкновение реакционными центрами.
5. Теория активированного состояния сосредоточивает внимание на том, что разрыв и образование химических связей при взаимодействии реагентов происходит в результате непрерывного изменения межатомных расстояний.
6. С увеличением концентрации реагентов скорость реакции увеличивается в соответствии с законом действия масс.
7. С увеличением температуры на 10 градусов скорость реакции увеличивается в 2 – 4 раза (правило Вант-Гоффа). Если известна энергия активации реакции Е, изменение скорости реакции с температурой можно рассчитать по уравнению Аррениуса.
8. Введение катализатора увеличивает скорость реакции. Роль катализатора сводится к понижению активационного барьера реакции. Катализатор участвует в химических реакциях. После завершения процесса катализатор сохраняется в неизменном виде.
9. Имеет смысл говорить о порядке и молекулярности простых реакций, включающих однотипные элементарные химические превращения. Сложная реакция включает главным образом моно-, бимолекулярные реакции, реже тримолекулярные реакции.
Термины для запоминания
Речь взаимосвязана с мышлением. Она отражает нашу способность мыслить и качество мышления (как говорим, так и думаем). Поэтому старайтесь воспроизводить главное из прочитанного лучше всего письменно (черновики). Ваша речь при объяснении материала должна сочетать ясность изложения с грамматически правильным построением фраз.
u = k×cA×cBC
1) столкновение реагентов;
2) столкновение с энергией активации Е;
3) столкновение реакционными центрами.
А + ВС ® АВ + С
Звено цепи есть последовательность элементарных химических актов продолжения цепи, заканчивающаяся на исходном атоме или радикале.








