Молекулярность и порядок реакции
Молекулярность реакции есть число частиц (атомов, молекул, ионов, радикалов), участвующих в элементарном акте. Например, реакция перегруппировки трифенил(триметилперокси)силана является мономолекулярной реакцией:
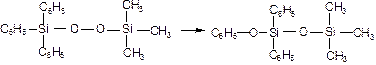
При горении водорода реакции зарождения, продолжения и разветвления цепи соответствуют бимолекулярным реакциям. В каждом элементарном акте участвуют две частицы, например
Н× + О2 ® продукты реакции.
Реакция обрыва цепи – тримолекулярная реакция. В каждом элементарном акте такой простой реакции участвуют три частицы (НО×, ×Н и М):
НО× + ×Н + М ® Н2О + М*
Роль третьей частицы М выполняет атом или молекула в стенке реактора или молекула в объеме реактора. Функция частицы М сводится к дезактивации образующейся молекулы Н2О. В результате тройного столкновения уменьшается кинетическая энергия, энергия колебательного движения атомов, способная разорвать связь в образовавшейся молекуле воды НО–Н. Часть колебательной энергии принимает на себя молекула М. Она переходит в возбужденное состояние М*, обеспечивая устойчивость молекулы воды.
В соответствии с законом действия масс уравнения скорости элементарных химических реакций записываются следующим образом:
для мономолекулярной реакции
А ® продукты u = kcA
для бимолекулярной реакции
2А ® продукты 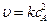
А + В ® продукты u = kcA сВ
для тримолекулярной реакции
2А + В® продукты 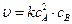
B + 2D® продукты 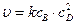
В общем виде для элементарной химической реакции
n А А + n В В ® продукты 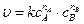 ,
,
где n i – стехиометрические коэффициенты уравнения химической реакции, а ni – показатели степени, с которыми концентрации реагентов входят в уравнение закона действия масс.
Для элементарных химических реакций стехиометрические коэффициенты и показатели степени, с которыми концентрации реагентов входят в уравнение скорости реакции, совпадают, т.е. n А = nA и n В = nB.
Показатель степени ni , с которым концентрация реагента входит в уравнение скорости реакции, обозначает порядок реакции по данному реагенту.
Общий порядок реакции равен сумме показателей степеней концентраций всех реагентов, которые входят в кинетическое уравнение скорости реакции. Например, для бимолекулярной простой реакции общий порядок равен двум: nA + nB.= 1 + 1 = 2.
Для мономолекулярной реакции превращения А в продукт реакции В:
А ® В
должно выполняться условие соударений как источник активационной энергии. Общепринятой схемой активирования молекул А в результате бимолекулярных соударений является схема Линдемана (1922 г.):
А + А ® А* + А (k1) бимолекулярная активация
А* + А ® А + А (k2) бимолекулярная дезактивация
А* ® В (k3) распад с образованием продукта
Бимолекулярные процессы активации и дезактивации обеспечивают некоторую стационарную концентрацию активированных молекул А*. Энергия столкновения превращается в колебательную энергию активированной молекулы А*. Через некоторое время молекула А* либо дезактивируется, либо распадется с образованием продукта реакции В.
Скорость расходования и образования активированных молекул в соответствии с принципом стационарности выражается уравнением:
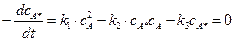 (5.8)
(5.8)
или 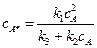 . (5.9)
. (5.9)
Скорость превращения А в В определяется скоростью реакции А* ® В:
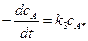 .
.
Подставляя в это уравнение концентрацию сА* из уравнения (5.9), получим выражение для скорости мономолекулярной реакции:
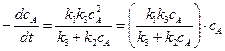 . (5.10)
. (5.10)
При большой концентрации вещества А, когда скорость дезактивации во много раз больше скорости распада, т.е. * k2cAcA * >> k3cA * или k2cAcA * >> k3cA, первым слагаемым в знаменателе уравнения (5.10) можно пренебречь по сравнению со вторым. В результате получим:
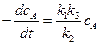 (5.11)
(5.11)
или u = kcA, где 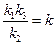 .
.
Мономолекулярное превращение вещества подчиняется уравнению реакции первого порядка.
Тримолекулярные элементарные реакции встречаются чрезвычайно редко. Вероятность тройного столкновения мала по сравнению со столкновениями двух частиц.
Не имеет смысла говорить о молекулярности сложной реакции. Она включает главным образом элементарные моно- и бимолекулярные реакции. Для сложных реакций частный и общий порядок реакции выражается как целыми, так и дробными числами, которые находят экспериментально. Например, скорость сложной реакции
H2(г)+ Br2(г) = 2HBr(г)
описывается уравнением:
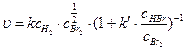 ,
,
включающим целочисленные и дробные частные порядки.
Сложная реакция
H2(г)+ I2(г) = 2HI(г)
является реакцией второго порядка
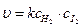 .
.
Формально наблюдается совпадение стехиометрических коэффициентов и частных порядков в уравнении скорости реакции. Но это лишь совпадение. Исследование механизма этой реакции показало, что образование HI включает моно- и тримолекулярные элементарные реакции.








