Простая реакция состоит из одних и тех же элементарных химических актов. Например, в приведенном на рис. 49 механизме элементарный химический акт
Н× + О2 ® НО× + ×О×
повторяется бесчисленное число раз, пока не израсходуются исходные реагенты – водород и кислород.
Сложная реакция включает несколько простых разнотипных реакций. Такой сложной реакцией является реакция горения водорода в кислороде.
Цепная реакция осуществляется путем многократного чередования элементарных актов с участием свободных радикалов и атомов. Конечным результатом цепной реакции является превращение исходных веществ в продукты. Горение водорода в кислороде – цепная разветвленная реакция.
Инициирование или зарождение цепи происходит при появлении атомов и радикалов из молекул. Например, реакция
Н2 + О2 ® Н× + НОО×.
Продолжение цепи обусловлено реакциями атомов и радикалов с молекулами исходных веществ (реагентов). При этом образуются не только продукты реакции, но генерируются новые атомы и радикалы. Например, так происходит в элементарной реакции
НО× + Н2® Н2О + Н×.
Разветвление цепи отличается от реакции продолжения цепи тем, что в элементарном акте разветвления цепи активная частица (атом или радикал) генерирует несколько активных частиц (атомов или радикалов). Например, к разветвленным относятся такие реакции:
Н× + О2 ® НО× + ×О×
Н2 + ×О×® НО× + Н×.
Обрыв цепи означает «гибель» активных частиц. Обычно это происходит в результате реакций между атомами и радикалами. Например, в реакции тройного столкновения
НО× + ×Н + М ® Н2О + М*.
Когда мы говорим о цепной химической реакции, то подразумеваем в качестве механического аналога металлическую цепь, состоящую из взаимосвязанных звеньев. Действительно, химическое звено цепи напоминает замкнутый цикл.
Звено цепи есть последовательность элементарных химических актов продолжения цепи, заканчивающаяся на исходном атоме или радикале. Например, исходным атомом, лежащим в основе развития цепного процесса окисления водорода кислородом, является активный атом водорода×Н (рис. 48). В одном элементарном акте атом водорода «гибнет», в другом – возрождается:
Н × + О2 ® НО× + ×О× НО× + Н2 ® Н2О + Н ×
Следующее звено повторяет ту же последовательность реакций.
Скорость реакции
Ограничимся описанием скорости гомогенных химических реакций, т.е. реакций, протекающих в газовой фазе или растворе.
Для гомогенных смесей реагентов скорость реакции определяется изменением концентрации реагента или продукта реакции во времени.
В качестве модели рассмотрим необратимую простую реакцию, элементарным химическим актом которой является превращение частиц А и ВС в продукты реакции АВ и С.
А + ВС ® АВ + С
Скорость химической реакции по условию есть положительная величина. Согласно определению:
u = 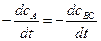 =
= 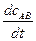 =
= 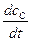 [моль/л×с], (5.1)
[моль/л×с], (5.1)
где u – скорость реакции [моль/л×с]; с – концентрация исходного вещества (реагента) или продукта реакции [моль/л]; t – время реакции в секундах [с].
В расчетах следует учитывать, что за бесконечно малый промежуток времени (dt > 0) концентрации исходных веществ уменьшаются (dcA < 0 и dcB С < 0), а концентрации продуктов реакции увеличиваются, поэтому в уравнении (5.1) вводится знак (-) при расчете скорости реакции по любому из исходных веществ.








