Влияние температуры на смещение химического равновесия
Химическое равновесие при заданных р,Т,с i = const есть динамическое равновесие. Изменение условий проведения реакции влечет за собой изменение функции Гиббса и, соответственно, смещение химического равновесия до нового устойчивого состояния, которому будет соответствовать DG = 0.
Для термохимического уравнения
nАА + nВВ ⇄ nСС + nDD; 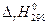 ,
,
будем считать в первом приближении, что 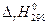 и
и 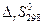 не зависят от температуры. Они сохраняют свои постоянные значения не только при 298 К, но и при любой другой температуре Т. Тогда
не зависят от температуры. Они сохраняют свои постоянные значения не только при 298 К, но и при любой другой температуре Т. Тогда 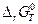 =
= 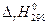 – Т ×
– Т × 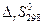 .
.
Вспомним, что для индивидуального вещества справедливо уравнение
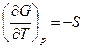 .
.
Для химической реакции оно имеет вид
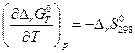 .
.
Следовательно,
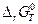 =
= 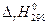 + Т
+ Т 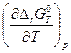 .
.
При р = const функция Гиббса зависит только от температуры:
- T × d 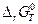 +
+ 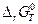 ×dT=
×dT= 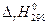 ×dT
×dT
При умножении левой и правой частей на 1/Т2 получим:
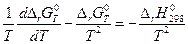 или
или
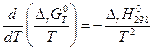 .
.
Так как 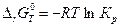 (см. уравнение 4.54),
(см. уравнение 4.54),
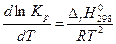 . (4.55)
. (4.55)
Уравнение (4.55) выражает зависимость константы химического равновесия от температуры и носит название уравнения изобары химической реакции.
Неопределенное интегрирование уравнения (4.55) приводит к выражению (4.56)
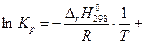 const. (4.56)
const. (4.56)
Графическая зависимость lnKp от 1/Т представлена на рис. 47. Графическое и аналитическое выражения зависимости константы равновесия от температуры свидетельствуют о смещении равновесия при повышении температуры реагирующих веществ в направлении понижения температуры, т.е. в направлении эндотермической реакции.
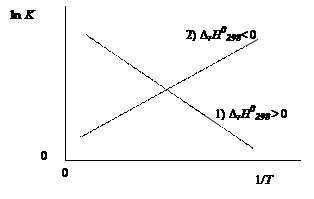
Рис. 47. Зависимость константы равновесия химической реакции от температуры (1/Т уменьшается): 1) (Dr Н0298 > 0) – эндотермическая реакция. Константа равновесия возрастает с ростом температуры; 2) (Dr Н0298< 0) – экзотермическая реакция. Константа равновесия уменьшается с ростом температуры
Влияние концентрации участников реакции на смещение химического равновесия
Модель смещения химического равновесия А ⇄ В
напоминает механическую модель смещения равновесия жидкостей в сообщающихся сосудах (рис. 48).
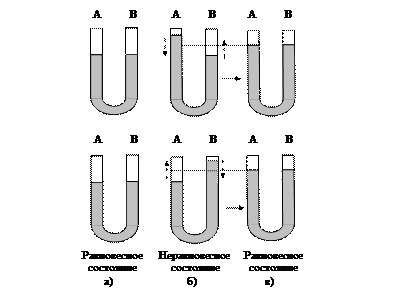
Рис. 48. Механическая модель равновесия: а - равновесное состояние; б - нарушение равновесного состояния, в левое (или правое) колено добавлена жидкость; система стремится ослабить внешнее воздействие, оно указано стрелками; в - новое равновесное состояние: система уменьшила внешнее воздействие
Процесс изменения концентраций, вызванный нарушением равновесия, называется сдвигом или смещением равновесия. Равновесие смещается вправо, так как добавленные в избытке исходные вещества реагируют между собой и дают дополнительное количество продукта реакции. В этом случае концентрации исходных веществ в левой части уравнения возросли подобно тому, как увеличился столб жидкости в левом (или правом) колене сообщающихся сосудов (рис. 48).








