Энтальпия образования всех простых веществ принята за начало отсчета и равна нулю.
Задачей термохимии является расчет энтальпий химических реакций 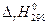 по табличным значениям
по табличным значениям 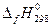 , опираясь на закон Гесса.
, опираясь на закон Гесса.
Основной закон термохимии (закон Гесса, 1836 г.) в современной интерпретации утверждает, что энтальпия реакций, протекающих либо при V , T = const, либо p , T = const не зависти от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы. Например, экспериментально невозможно определить значение DH1 реакции:
С(гр) + 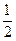 О2(г) ® СО(г); DH1 = ?
О2(г) ® СО(г); DH1 = ?
так как при сжигании графита, как правило, образуется смесь оксидов (СО2 и СО).
В соответствии с законом Гесса можно преодолеть это затруднение, измерив экспериментально (в калориметре) энтальпии следующих реакций:
С(гр) + О2(г) ® СО2(г); DH2 = - 393,51 кДж/моль,
СО(г) + 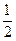 О2(г) ® СО2(г); DH3 = - 282,99 кДж/моль.
О2(г) ® СО2(г); DH3 = - 282,99 кДж/моль.
Представим возможные пути превращений исходных соединений.
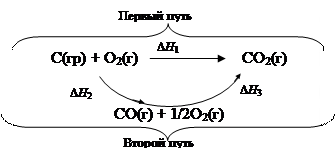
Поскольку DH есть функция состояния системы, в которой происходят реакции, то в соответствии с законом Гесса независимо от того, идет реакция по первому или второму пути:
DH1 = DH2 + DH3 или
DH2 = DH1 - DH3 = (- 393,51) - (- 282,99 ) = - 110, 52 кДж.
Именно столько энергии выделяется (экзотермический процесс) при образовании 1 моль СО из С(гр) и 1/2О2(г). Эта величина вычислена теоретически.
В соответствии с законом Гесса с термохимическими уравнениями можно обращаться как с алгебраическими. Их можно складывать друг с другом или вычитать из одного уравнения другое. Именно эти операции используют при вычислении энтальпии реакции 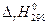 (r – reaction), используя табличные данные энтальпий образования
(r – reaction), используя табличные данные энтальпий образования 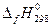 участников термохимической реакции.
участников термохимической реакции.
Воспользуемся табличными данными термохимических величин, приведенных в приложении, для вычисления энтальпии реакции разложения карбоната кальция:
СаСО3(т) ® СаО(т) + СО2(г); 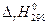 = ?
= ?
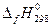 кДж/моль: - 1206 - 635.1 - 393.51
кДж/моль: - 1206 - 635.1 - 393.51
Для того чтобы вычислить 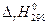 указанной реакции, необходимо из суммы энтальпий образования продуктов реакции вычесть сумму энтальпий образования исходного вещества:
указанной реакции, необходимо из суммы энтальпий образования продуктов реакции вычесть сумму энтальпий образования исходного вещества:
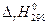 = [S
= [S 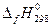 прод.] - [S
прод.] - [S 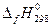 исх.],
исх.],
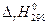 = [(- 635.1) + (- 393.51)] - [- 1206] = 177.39 кДж.
= [(- 635.1) + (- 393.51)] - [- 1206] = 177.39 кДж.
В том, что именно такую алгебраическую операцию нужно совершить, можно убедиться, если записать реакции образования участников процесса:
Са(т) + 1/2О2(г) ® СаО(т); 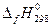 (СаО) = - 635.1 кДж,
(СаО) = - 635.1 кДж,
С(т) + О2(г) ® СО2(г); 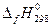 (СО2) = - 393.51 кДж,
(СО2) = - 393.51 кДж,
С(т)+3/2О2(г)+С(т)®СаСО3(т); 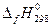 (СаСО3) = - 1206 кДж.
(СаСО3) = - 1206 кДж.
При вычитании из алгебраической суммы первых двух уравнений третьего и выполнении необходимых сокращений и переносов получим:
СаСО3(т) ® СаО(т) + СО2(г); [(- 635.1) + (- 393.51)] - [- 1206],
СаСО3(т) ® СаО(т) + СО2(г); DrН0(298) = 177.39 кДж.
4.5. Второй закон термодинамики
Движущей силой любого процесса, совершающегося в системе, является ее неустойчивость. Только в этом случае система самопроизвольно переходит из неустойчивого в устойчивое состояние. Брусок, расположенный на определенной высоте, самопроизвольно падает на поверхность пола, но никогда не вернется в исходное положение самопроизвольно. Заметим, что потенциальная энергия падающего бруска спонтанно уменьшается. Возможно, направление самопроизвольного процесса связано со стремлением системы к минимуму энергии? Но в соответствии с первым законом термодинамики в окружающей среде происходит самопроизвольное возрастание энергии на ту же величину. Другими словами, изменение энергии системы и окружающей среды не может служить критерием направления самопроизвольного процесса.
В конце XIX и начале ХХ вв. два выдающихся физика-теоретика Р. Клаузиус и В. Томсон в своих исследованиях установили, что полное количество энергии в любом процессе должно сохраняться в соответствии с первым законом термодинамики, а распределение имеющейся энергии осуществляется необратимым образом. Последняя фраза означает, что энергия превращается самопроизвольно в менее ценные формы. Одна из многих формулировок второго закона термодинамики утверждает: невозможен круговой (циклический) процесс, имеющий единственным своим результатом превращение теплоты в работу. Поршни в двигателе автомобиля должны совершать циклически повторяющиеся движения, чтобы заставить вращаться коленчатый вал. При этом в атмосферу выбрасываются горячие выхлопные газы. Следовательно, часть энергии, выделяющаяся при сжигании топлива, расходуется не на движение автомобиля, а на нагревание окружающей среды. И эта энергия не может быть превращена в работу.
В начале XIX в. французский инженер С. Карно доказал, что идеальная тепловая машина, действующая циклически (цикл Карно), не может полностью превратить теплоту в работу. Позже математическое выражение коэффициента полезного действия машины h, работающей по циклу Карно, дал соотечественник Карно, инженер Б. Клапейрон:
h 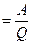 или h
или h 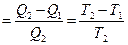 .
.
В двигателе современного автомобиля температура сгорания топлива достигает 14000С (1673 К). Выхлопные газы, выбрасываемые в атмосферу, имеют температуру около 10000С (1273 К). Коэффициент полезного действия такого двигателя составляет: h = (1673-1273)/1673 = 0,24 или 24%.
Энтропия
Обратимся к модели самопроизвольного необратимого превращения энергии на примере механической модели, предложенной Эткинсом (рис. 44).
Потенциальная энергия падающего тела превращается в энергию движения микрочастиц поверхности пола. Энергия системы остается постоянной, происходит лишь ее перераспределение. Обратный процесс перемещения тела из состояния 2 в состояние 1 невозможен. Тело самопроизвольно не вернется в исходное состояние, т.к. частицы, расположенные на поверхности пола, рассеяли полученную энергию по всей поверхности пола в результате межмолекулярных соударений.
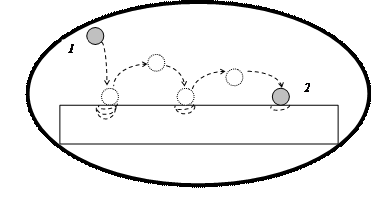
Рис. 44. Модель рассеяния энергии (увеличения беспорядка) в результате падения шарика на поверхность пола. Цифрами обозначены: 1 - начальное, 2 - конечное состояние системы. Стрелки указывают направление самопроизвольного (необратимого) процесса. Система изолирована от окружающей среды
Обычно математическое выражение второго закона термодинамики дается на примере цикла Карно или выводится с использованием принципа Каратеодори.
Мы ограничимся следующим уравнением второго закона термодинамики
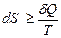 , (4.22)
, (4.22)
принимая его как закон, который, как и любой фундаментальный закон, не выводится.
Для термодинамически равновесного (обратимого) процесса уравнение (4.22) принимает вид:
dSобр. 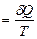 (4.23)
(4.23)
В термодинамически неравновесном (необратимом) процессе
dSнеобр. 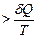 . (4.24)
. (4.24)
Изменение энтропии как критерий направления процесса применим к изолированным системам. Так как изолированная система не обменивается энергией с окружающей средой, для нее d Q = 0 и, соответственно, для состояния термодинамического равновесия в изолированной системе
dSсист. = 0 (4.25)
для необратимого процесса, протекающего в изолированной системе
dSсист. > 0. (4.26)
Одна из формулировок второго закона термодинамики гласит: любой необратимый процесс характеризуется увеличением энтропии изолированной системы (dSсист. > 0) и любой обратимый процесс характеризуется неизменностью энтропии изолированной системы (dSсист. = 0).
На примере изолированной системы, состоящей из горячего и холодного тел (рис. 45), покажем, что процессы обмена энергией в форме теплоты между телами сопровождаются ростом энтропии. Изменение энтропии системы равно сумме изменений энтропии входящих в состав данной системы тел.
dSсист. = dS 1+ dS 2 или
dSсист. 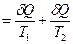 . (4.27)
. (4.27)
Горячее тело при Т1 обменивает с холодным телом, находящимся при температуре Т2, бесконечно малое количество энергии. Количество теплоты δ Q настолько малое, что температура тел практически не меняется и Т1 >> Т2.
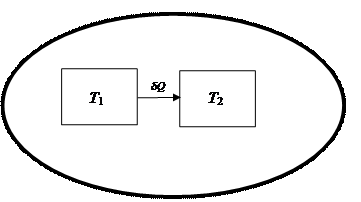
Рис. 45. Обмен энергией горячего (Т1) и холодного (Т2) тел в изолированной системе
В соответствии с принятой в термодинамике шкалой δ Q < 0 для горячего тела и δ Q > 0 для холодного. Следовательно, в уравнении (4.27) отношение 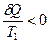 , а
, а 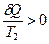 . По абсолютной величине
. По абсолютной величине 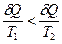 , следовательно
, следовательно
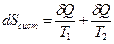 >0.
>0.
Таким образом, только самопроизвольные процессы передачи тепла от горячего тела к холодному протекают в изолированной системе.
Функция Гиббса
Второй закон термодинамики, опирающийся на концепцию энтропии как критерий самопроизвольного процесса в изолированной системе, применим к любым системам, при условии учета всех без исключения внешних объектов, которые обмениваются с системой энергией. Фактически это означает рассмотрение изолированной совокупности тел система – окружающая среда. При этом приведенный ниже расчет позволяет судить о направлении самопроизвольного процесса только по параметрам системы.
dS = dSокр. среда + dSсист. = d Qокр. среда/Токр. среда + dSсист. ³ 0 (4.28)
В соответствии с законом сохранения энергии количество энергии в форме теплоты, поступившее из окружающей среды в систему, равно теплоте, полученной системой:
- d Qокр. среда = d Qсист.. (4.29)
Если процесс в системе (например, химическую реакцию в сосуде) проводят при постоянной температуре, равной температуре окружающей среды, то
Токр.среда = Тсист. =Т. (4.30)
Преобразуем уравнение (4.28), учитывая уравнения (4.29) и (4.30)
(dSсист. - d Qсист./Т) ³ 0. (4.31)
Получили уравнение (4.31), не содержащее параметров, относящихся к окружающей среде. Оно отражает направление самопроизвольного процесса или состояние термодинамического равновесия только через свойства системы, поэтому, отбросив индексы (все они относятся к системе), запишем:
(dS - d Q/Т) ³ 0. (4.32)
Если процесс проводят при постоянной температуре и давлении (Т,р = const), а это наиболее часто встречающийся случай проведения физико-химических процессов, то выражение первого закона термодинамики d Q = dU + pdV примет вид d Qр = d( U + pdV) или d Qр = dН. Соответственно уравнение (4.32) запишется:
(dН – TdS) £ 0.
Поскольку энтропия и энтальпия являются функциями состояния системы, их разность также является функцией состояния.
d(Н – TS) £ 0,
разность H – TS обозначим символом G. Функция состояния системы G = H – TS, впервые введенная Гиббсом, носит название функции Гиббса.
По изменению функции Гиббса
dG = dН – TdS £ 0 (4.33)
можно судить о течении самопроизвольного процесса в исследуемой системе, происходящего при р,Т = const.
Интегрируем уравнение (4.33)
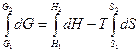 ,
,
G2 – G1 = (H2 – H1) – T(S2 – S1),
DG = DH – TDS. (4.34)
Для любой химической реакции изменение функции Гиббса служит критерием направления химического превращения.
Если DG < 0, самопроизвольный процесс происходит в направлении: исходные вещества ® продукты реакции.
Если DG > 0, процесс идет в направлении: продукты реакции ® исходные вещества.
Если DG = 0, система находится в состоянии термодинамического равновесия.
Ответ на вопрос, почему идут химические реакции, очевиден, – реакционная система стремится перейти в устойчивое состояние.
Достижение химического равновесия между реагентами А, ВС и продуктами реакции АВ и С
А + ВС ⇆ АВ + С
подобно движению шарика по склону ложбины (рис. 46). Движение может осуществляться самопроизвольно со стороны веществ (А + ВС) или со стороны веществ (АВ + С).
Для определения направления смещения равновесия рассчитывают значения 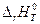 и
и 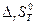 , подставляют в уравнение
, подставляют в уравнение 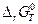 =
= 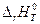 – Т
– Т 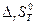 , (4.35)
, (4.35)
и по знаку 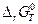 устанавливают направление термодинамически разрешенной реакции.
устанавливают направление термодинамически разрешенной реакции.
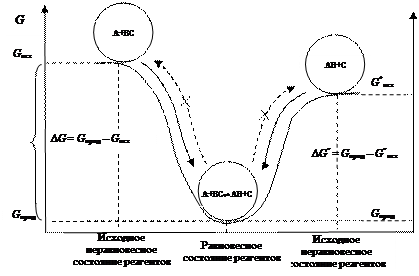
Рис. 46. Модель, демонстрирующая направление термодинамически разрешенного процесса, аналогична скатыванию шара в ложбину (самопроизвольный процесс)








