Энергии связей некоторых двух- и трехатомных молекул
| Молекула | Разрываемая связь | Образующиеся частицы | Энергия связи Е, кДж/моль |
| Н2 | H–H | H + H | 436 |
| F2 | F–F | F + F | 159 |
| HF | H–F | H + F | 568,5 |
| H2O | H–OH | H + OH | 498,7 |
| OH | O–H | O + H | 427,8 |
| O2 | O=O | O + O | 498,4 |
| CO2 | O=CO | O + CO | 532,2 |
| CO | CºO | C + O | 1076,4 |
| N2 | NºN | N + N | 945,3 |
| NO | N=O | N + O | 632 |
Термохимические расчеты
Различают экзо- и эндотермические реакции. Химические реакции, сопровождающиеся выделением или поглощением энергии в форме теплоты, называются соответственно экзотермическими и эндотермическими реакциями. Энтальпия реакции 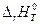 равна количеству энергии в форме теплоты, выделяющейся или поглощающейся в результате химического процесса при постоянных р = 1 атм и температуре Т.
равна количеству энергии в форме теплоты, выделяющейся или поглощающейся в результате химического процесса при постоянных р = 1 атм и температуре Т.
Пример. Чему равна энтальпия реакции образования фтороводорода, если известны энергии связей исходных веществ и продукта реакции.
Решение
Энтальпия D Н реакции вычисляется по термохимическому уравнению:
H2(г) + F2(г) = 2HF(г); D Н=?
Форма уравнения химической реакции, указывающая агрегатные состояния участников процесса и его энтальпию, называется термохимическим уравнением.
Для разрыва химических связей в молекулах Н2 и F2 требуется затратить (согласно табл. 3) 436 и 159 кДж энергии соответственно. Это эндотермический процесс. Значения энергии берутся со знаком (+).
При образовании химических связей в молекулах НF выделяется энергия. Это экзотермический процесс. Перед значениями энергии связи ставится знак (- ) (-568,5 кДж).
D Н= Е(Н - Н) + Е( F - F ) +2Е(Н - F )
D Н= [436 +159] +2 [-568,5] = - 542кДж.
Образование двух молекул НF приводит к выделению 542 кДж энергии. Реакция экзотермическая.
Пример. Оксид азота NO образуется при грозовых электрических разрядах в облаках. Чему равна энтальпия реакции окисления 84 г азота атмосферным кислородом?
Решение
N2(г) + О2(г) = 2NO(г), DН =?
Eсв +945,3 +498,4 2 (–632)
Используются данные, приведенные в табл.3.
DН1 = [945,3 + 498.4] + 2 [–632] = 179.7 кДж.
При окислении 84 г N2 (3 моль азота):
DН2 = 3×179.7 = 539.1 кДж.
Окисление 84 г азота в избытке кислорода сопровождается поглощением из окружающей среды 539,1 кДж энергии. Реакция эндотермическая.
Приведенные в примерах расчеты DН по энергиям химических связей имеют ограниченное применение и используются в основном для двух- и трехатомных молекул.
В термохимии основными данными для проведения термохимических расчетов служат энтальпии образования сложных соединений из простых веществ 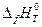 (f – formation). Энтальпия образования
(f – formation). Энтальпия образования 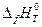 сложного вещества есть энтальпия реакции синтеза его из простых веществ, взятых в наиболее устойчивых физических состояниях при заданном внешнем давлении р = 1 атм и температуре Т.
сложного вещества есть энтальпия реакции синтеза его из простых веществ, взятых в наиболее устойчивых физических состояниях при заданном внешнем давлении р = 1 атм и температуре Т.
Под простыми веществами подразумеваются все химические элементы периодической системы в кристаллической форме, характерной для металлов (за исключением ртути), и молекулярной форме для неметаллов (за исключением благородных газов) в том агрегатном состоянии, которое для них характерно при внешнем давлении 1 атм.
Для внешнего давления, равного 1 атм и температуре T = 298.15 К, в справочных таблицах термодинамических величин (см. приложение) даются стандартные энтальпии образования соединений разной степени сложности. Например, энтальпия образования 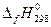 СО2(г) = - 393.51 кДж/моль относится к реакции
СО2(г) = - 393.51 кДж/моль относится к реакции
С(графит) + О2(г) = СО2(г);
С(графит) и О2(газ) – простые вещества.








