Закон термического равновесия утверждает, что две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом (рис. 34).
 |
Рис. 34. Термическое равновесие между телами. Если Т1 = Т3 и Т2 = Т3, то Т1 = Т2
4.2. Первый закон термодинамики
Любая система обладает энергией. Энергия – есть качественная и количественная характеристика движения и взаимодействия объектов материального мира.
Твердые тела, жидкости и газы проявляют разнообразные свойства, зависящие от природы атомов и молекул, составляющих эти тела. Они способны обмениваться энергией с окружающей средой, изменять агрегатное состояние в результате фазовых переходов или химический состав в результате реакций, проявлять (или не проявлять) ионную и электронную проводимость, разную степень теплопроводности, теплоемкости и бесчисленное число других физико-химических свойств. Процесс изменения физико-химического состояния вещества подчиняется фундаментальному закону сохранения энергии: энергия не возникает из ничего и не исчезает бесследно; она лишь превращается из одних видов в другие в строго эквивалентных количествах. Закон есть результат многовековых наблюдений, подтверждается экспериментальными данными и не имеет исключений.
Первый закон термодинамики есть частный случай закона сохранения энергии. Он применим к тепловым процессам, в которых обмен системы энергией с окружающей средой осуществляется в форме теплоты Q и работы А.
Рассмотрим систему, представляющую собой идеальный газ в цилиндре под поршнем (рис. 35). Внешним источником энергии для такой системы выступает нагреватель. Пусть нагреватель передает идеальному газу некоторое количество энергии в форме теплоты Q [Дж]. В результате такого воздействия увеличивается внутренняя энергия системы DU (поднимается температура газа) и совершается работа А перемещения груза на некоторую высоту. В соответствии с законом сохранения энергии получаем:
Q = DU + А (4.6)
Уравнение (4.6) является аналитическим выражением первого закона термодинамики: энергия, полученная (отданная) системой в форме теплоты, равна алгебраической сумме изменения её внутренней энергии и совершенной ею (над ней) работы.
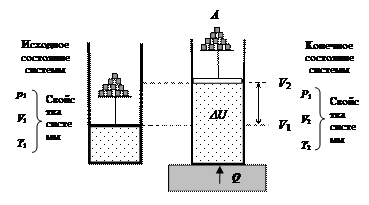
Рис. 35. Изменение энергетического состояния системы (газ в цилиндре под поршнем) при нагревании
Формулировка первого закона указывает, что движение энергии возможно в любых направлениях и к системе, и от неё. На рис. 36 демонстрируются принятые в термодинамике знаки для работы, теплоты и внутренней энергии.
Пример . При сгорании 10 л бензина в автомобильном двигателе выделилось энергии в форме теплоты Q(горение) = 460×103 кДж. На нагревание окружающей среды (раскаленные выхлопные газы) затрачено энергии в форме теплоты Q(окр. среда) = 345×103 кДж. Часть энергии сгоревшего бензина израсходована на увеличение внутренней энергии DU = 10×103 кДж (нагревание двигателя). Вычислить количество бензина, израсходованное на движение автомобиля. И определить коэффициент полезного действия машины, работающей на бензине.
Решение
Согласно первому закону термодинамики
Q = DU + А
460×103 + (-345×103)= 10×103 + А
А = 105×103 кДж.
Коэффициент полезного действия h равен:
h 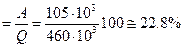 .
.
Из 10 л бензина на движение автомобиля расходуется V = 10×0,228 = 2.28 л, а 7.72 л израсходованы на нагревание окружающей среды, включая нагревание двигателя, который при остывании также нагревает воздух.
В термодинамике принята следующая система знаков для оценки направления процессов обмена энергией системы с окружающей средой (рис. 36).
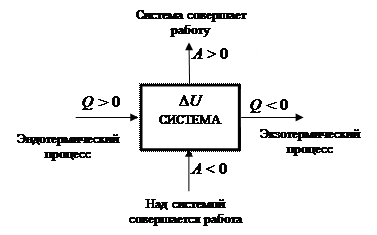 |
Рис. 36. Модель возможных маршрутов обмена энергией системы с окружающей средой в форме теплоты и работы
Эндотермический [ др.-греч endon внутри, qermh тепло] процесс – есть процесс, происходящий с поглощением системой энергии в форме теплоты (Q) из окружающей среды. Численное значение (Q) берется со знаком плюс, например, (Q) = + 100 кДж.
Экзотермический [др.-греч. exw снаружи, вне] процесс – есть процесс, происходящий с выделением системой энергии в форме теплоты (Q) в окружающую среду. Численное значение берется со знаком минус, например,
(Q) = - 100 кДж.
Для работы знаки выбираются иначе. Если система совершает работу, она считается положительной. Например, автомобиль (система) везет пассажиров. Но если приходится пассажирам толкать машину, у которой заглох двигатель, то эта работа считается отрицательной.
4.3. Свойства термодинамической системы
Системе присущи такие свойства, как объем V, давление р, температура Т, концентрация с i, теплоемкость Ср или CV, внутренняя энергия U, а совокупность свойств определяет состояние системы. Если изменилось состояние системы, изменяются её свойства. Изменение состояния системы называется процессом. Подчеркнем, что изменение свойств не зависит от пути перехода системы из начального состояния в конечное.
Между свойствами системы существуют определенные функциональные связи. Например, уравнение состояния идеального газа 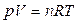 связывает свойства таким образом, что любое из них можно определить, если известны другие.
связывает свойства таким образом, что любое из них можно определить, если известны другие.
Важнейшими понятиями в термодинамике являются внутренняя энергия, теплота, теплоемкость, работа. Обмен внутренней энергией U термодинамической системы (в дальнейшем термодинамическую систему будем называть просто системой) с окружающей средой осуществляется либо в форме работы А, либо в форме теплоты Q, либо одновременно в обеих формах. Подчеркнем, что термодинамика рассматривает только две формы передачи энергии – теплоту и работу и не рассматривает, например, обмен системы энергией с окружающей средой посредством электромагнитного излучения.








