Гибридизация представляет собой способ описания перестройки атомных орбиталей в молекуле по сравнению со свободным атомом.
Длина ионной связи соответствует расстоянию между центрами ионов.
Длина ковалентной связи – это расстояние между ядрами ковалентно связанных атомов молекулы.
Длина металлической связи – это расстояние между узлами металлической кристаллической решетки, в которых расположены положительно заряженные ионы.
Донор электронов располагает атомом, одна из орбиталей которого содержит свободную пару электронов.
Донорно-акцепторная ковалентная связь – связь между атомами, образующаяся при участии пары электронов электронодонора и вакантной орбитали электроноакцептора.
Ионная связь обусловлена взаимодействием противоположно заряженных сферических ионов, удерживающая их на расстоянии длины химической связи.
Ковалентная s-связь – связь между атомами, образующаяся при перекрывании атомных орбиталей вдоль линии, проходящей через ядра атомов.
Ковалентная связь обусловлена электромагнитным взаимодействием, удерживающим положительно заряженные ядра отрицательным зарядом, сосредоточенным в области перекрывания атомных орбиталей.
Металлическая связь обусловлена электромагнитным взаимодействием, удерживающим положительно заряженные ионы в узлах кристаллической решетки подвижными электронами («электронным газом»).
Молекула – микросистема, состоящая из двух или большего числа ядер и электронов, движущихся в поле ядер, и содержащая ковалентные связи.
Порядок связи ( W ) в методе МО – есть число, равное разности между количеством электронов на связывающих и разрыхляющих орбиталях, поделенной на 2.
p -Связь – связь между атомами осуществляется так, что образуются две области перекрывания р-орбиталей по обе стороны от оси s -связи.
Химическая связь обусловлена электромагнитным взаимодействием, удерживающим систему ядер и электронов в молекулах или кристаллах.
Электроотрицательность – параметр, характеризующий способность атома притягивать к себе электрон.
Вопросы для проверки знаний
1. Что подразумевается под молекулой?
2. В чем различие и сходство между ковалентной и ионной связью?
3. В чем разница между s и p ковалентными связями?
4. Что, на ваш взгляд, явилось причиной введения представления о гибридизации атомных орбиталей?
5. Какой физический смысл вкладывается в понятия «направленность» и «насыщаемость» ковалентных связей?
6. В чем различие и сходство между ионной и металлической связями?
7. Согласны ли вы с утверждением, что «химическая связь обусловлена электрическими силами притяжения и отталкивания»?
8. В чем сильные и слабые стороны методов валентной связи и молекулярных орбиталей?
9. Что подразумевается под структурной и молекулярной формулами?
10. В чем различие и сходство между ковалентной полярной и неполярной связями?
11. Можно ли назвать ионное соединение LiF молекулой?
12. Какой механизм образования ковалентной связи называется донорно-акцепторным?
13. Какая связь называется металлической?
Упражнения
1. Химическая связь в молекуле изменяет свою длину в результате колебательного движения атомов. Согласуется ли этот факт с тем, что в справочниках дается единственное значение длины химической связи?
2. Можно ли утверждать, что кристалл хлорида натрия состоит из молекул NaCl?
3. С позиций метода ВС О2 не имеет неспаренных электронов. Докажите, что с позиций метода МО О2 имеет два неспаренных электрона.
4. Постройте энергетические диаграммы молекул N2, F2 и определите порядок связей.
5. Докажите, существует ли ион 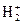 с позиций: а) метода ВС; б) метода МО?
с позиций: а) метода ВС; б) метода МО?
ТЕМА 3








