На рис. 9 представлена молекула метана СН4 с ковалентными s-связями. Ковалентная s-связь образуется между атомами при перекрывании орбиталей вдоль линии, проходящей через ядра атомов.
Рассмотрим структуру пятиатомной молекулы метана СН4. Четыре ковалентных связи (темные линии) расположены в пространстве симметрично (рис. 9). Если атом углерода поместить в центре тетраэдра, то химические связи, соединяющие атом углерода с атомами водорода, направленны к его вершинам. Как могли образоваться четыре равноценные связи в метане при наличии в атоме углерода двух электронов, расположенных на 2р-орбиталях, напоминающих по форме спортивные гантели, и двух электронов на сферической 2s-орбитали?
Это возможно, если атом углерода переходит из основного 1s22s22p2 в возбужденное состояние 1s22s12p3, перестраивая внешние электронные оболочки (рис. 10). На рис. 11 показано sp 3 гибридное состояние атома углерода в молекуле метана.
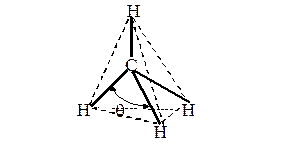
Рис. 9. Модель молекулы метана. Угол q между С—Н связями составляет 109.280
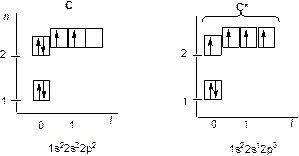
Рис. 10. Распределение электронов по энергетическим уровням
(квантовым ячейкам) в атоме углерода: основное состояние С и возбужденное состояние С*
Гибридизация представляет собой способ описания перестройки атомных орбиталей в молекуле по сравнению со свободным атомом. Эта идея принадлежит выдающимся физикам Л. Полингу и Д. Слэтеру.
|

|
|
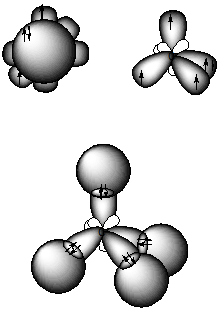
Рис. 11. Состояние атома углерода (sp 3 гибридизация) в молекуле метана
Гибридизация позволяет объяснить существование не только одинарных, но двойных и тройных связей между атомами. В молекуле метана (рис. 11 и 12 а) sp 3-гибридизация атома углерода обеспечивает расположение ковалентных s-связей под углом 109.280.
В молекуле этилена атом углерода существует в sp 2 гибридном состоянии. Три sp 2-гибридные орбитали углерода расположены в одной плоскости под углом 1200 и одна р-орбиталь перпендикулярна плоскости. В молекуле этилена Н2С=СН2 между атомами углерода образуется двойная связь: одна – s (сигма)-связь, вторая – p (пи)-связь (рис. 12, б). p -Связь между атомами осуществляется таким образом, что образуются две области перекрывания р-орбиталей по обе стороны от оси s -связи.
В молекуле ацетилена НС≡СН, имеющей тройную химическую связь, атомы углерода находятся в состоянии sр-гибридизации. В атомах углерода ацетилена существуют две взаимно перпендикулярные р-орбитали и две sp-гибридных орбитали, находящиеся под углом 1800 (рис. 12, в).
а) б) в)
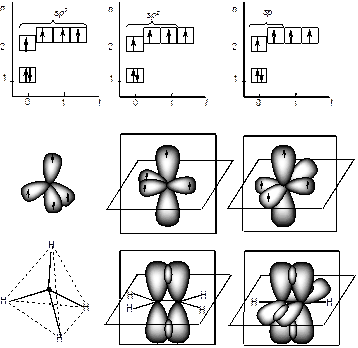
Рис. 12. Положение s- и p-связей в молекулах метана, этилена и ацетилена; s-связи представлены линиями, p-связи – перекрыванием р-орбиталей
2.3. Донорно-акцепторная связь
Взаимодействия молекул с образованием донорно-акцепторной ковалентной связи широко распространены. Такие связи еще называются координационными.








