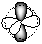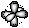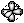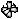Квантовыми называют целые или дробные числа, которые определяют значения физических величин, характеризующих атом, ядро атома, молекулу или элементарные частицы.
Параметр, с помощью которого можно вычислить энергию электрона в атоме, называется главным квантовым числом n . Оно принимает значения 1, 2, 3, 4.... Чем больше n, тем больше энергия электрона в атоме. Обратимся к атому водорода. Для него значение Е энергетического (электронного) уровня вычисляется по уравнению:
Е = - const/n2,
где const - постоянная величина. Чем больше отрицательное значение Е, тем меньше энергия энергетического уровня. И, наоборот, по мере роста n отрицательное значение Е уменьшается и, соответственно, растет энергия уровня.
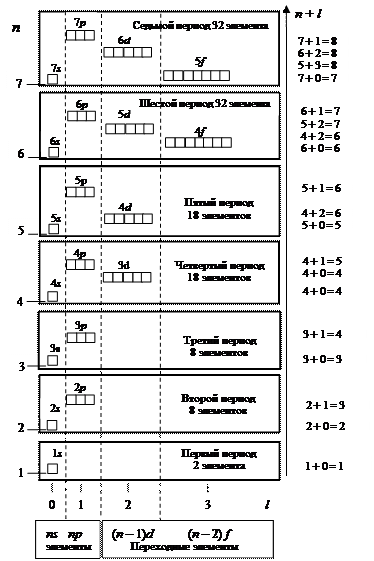 |
Рис. 6. Порядок заполнения электронами энергетических уровней в многоэлектронных атомах. За исключением первого периода, каждый период начинается и заканчивается заполнением ns - и np -орбиталей.
Форма орбитали и энергия подуровня определяется орбитальным квантовым числом l .
Значения l зависят определенным образом от главного квантового числа. Каждому значению n соответствует одно или несколько значений l:
значения n: 1 2 3 4
значения l: 0 0, 1 0, 1, 2 0, 1, 2, 3
Из сравнения n и l следует, что орбитальное квантовое число принимает целые значения от 0 до n - 1 для данного значения n. Квантовое число l определяет конфигурацию орбиталей. Если l равно 0, орбиталь имеет сферическую форму, это s-орбиталь. По мере увеличения значения главного квантового числа увеличиваются размеры орбиталей и возникает разнообразие форм орбиталей. Орбитальному квантовому числу l =1 соответствуют р-орбитали. Форма орбиталей усложняется по мере роста орбитального квантового числа.
Число орбиталей для данного значения l определяется магнитным квантовым числом ml : Для каждого значения l получается ряд значений ml, изменяющихся в интервале -l... 0...+ l. Значение ml, равное 0, соответствует одной s-орбитали на любом энергетическом уровне, определяемом главным квантовым числом n. Три значения ml (-1, 0, +1) соответствуют трем р-орбиталям, пять значений ml (-2,-1, 0, +1, +2) соответствуют пяти d-орбиталям и т. д. Магнитное квантовое число указывает также положение орбиталей в пространстве.
Начиная со второго энергетического уровня, кроме s-орбитали, появляются три р-орбитали (рх, ру и рz), расположенные под углом 900. На третьем энергетическом уровне появляются пять 3d -орбиталей. Такая последовательность увеличения числа орбиталей продолжается вплоть до седьмого периода. Электроны обладают собственным моментом количества движения – спином. Это движение позволяет отличить электроны, находящиеся на одной орбитали. Характеристикой спина электрона является спиновое квантовое число ms, которое принимает значения +1/2 и -1/2. На атомных орбиталях или в квантовых ячейках различие спинов наглядно изображают стрелками ¯.
Таким образом, четыре квантовых числа n , l , ml , ms определяют следующие характеристики атома:
- число энергетических уровней (n); n = 1, 2, 3,….¥;
- численное значение энергии уровня и подуровня
(n , l); l = 0, 1, 2,…( n-1);
- форму и пространственное расположение орбиталей (l , ml ,), ml = - l…-2, -1, 0, +1, +2,….+ l;
- число орбиталей на подуровне ( ml);
- число электронов на орбитали (ms = ± 1/2).
Использование квантовых чисел и квантовых правил позволяет определить, как заполняются электронами энергетические уровни в многоэлектронном атоме (рис. 6). Квантовых правил три:
-принцип наименьшей энергии (правило Клечковского): электроны заполняют орбитали в порядке возрастания энергии от низшего к высшему энергетическому уровню. Другими словами, заполнение происходит по мере роста суммы квантовых чисел (n + l); если сумма (n + l) имеет одинаковые значения, то сначала заполняется уровень с меньшим n;
-принцип запрета Паули: на одной орбитали не может быть больше двух электронов, причем их спины должны быть противоположны (ms = +1/2 и -1/2).
Ниже показано разрешенное и не разрешенное заполнение квантовых ячеек (орбиталей):
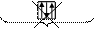 | |||
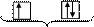 | |||
разрешенное не разрешенное
| ||||||||||||||
1 | 2 | |||||||||||||
| 1 | H

| |||||||||||||
| 2 | Li

| Be

|
| |||||||||||
| 3 | Na | Mg | ||||||||||||
| 3 | 4 | 5 | 6 | 7 | 8 | |||||||||
| 4 | K

| Ca

| Sc | Ti | V | Cr | Mn | Fe | ||||||
| i | Rb

| Sr

| Y | Zr | Nb | Mo | Tc | Ru | ||||||
| 6 | Cs

| Ba

| La | Hf | Ta | W | Re | Os | ||||||
| 7 | Fr

| Ra

| Ac | Rf | Db | Sg | Bh | Hs | ||||||
| ||||
| ||||
| 13 | 14 | 15 | 16 | 17 | 18 | ||||
He
| |||||||||
|
| B
| C | N | O | F | Ne | |||
|
| Al
| Si | P | S | Cl | Ar | |||
| 9 | 10 | 11 | 12 | ||||||
| Co | Ni | Cu | Zn | Ga

| Ge

| As
| Se
| Br
| Kr

|
| Rh | Pd | Ag | Cd | In

| Sn

| Sb
| Te
| I
| Xe
|
| Ir | Pt | Au | Hg | Tl

| Pb

| Bi

| Po
| At
| Rn
|
| Mt | 118 
| ||||||||
-правило Гунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором сумма спиновых чисел максимальна ( å ms = max)
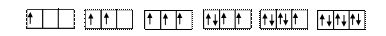
å ms = +1/2 +1 +3/2 +1 +1/2 0
Квантовым ячейкам ••• соответствует три взаимно перпендикулярные р-орбитали. Сила электростатического отталкивания между электронами, заполняющими р-орбитали, будет наименьшей, когда первые три электрона располагаются на удаленных друг от друга трех р-орбиталях. Четвертый и последующие электроны «вынуждены» располагаться на орбиталях, уже содержащих электроны. Их спины противоположны по знаку, поэтому сумма спинов уменьшается
В соответствии с квантовыми правилами заполняются электронные уровни в многоэлектронных атомах. На рис. 7 представлен график изменения атомного радиуса (r) от заряда ядра (Zя).
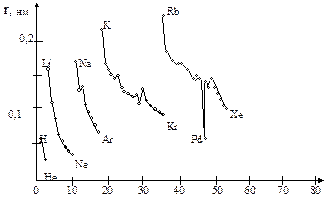 Zя
Zя
Рис. 7. Периодическое изменение радиусов атомов от заряда ядра
Атомы проявляют свойство изменять геометрическую конфигурацию и размеры. Радиусы атомов уменьшаются с ростом заряда ядра в периоде и увеличиваются в группе. Это наглядно показано в табл. 1. Завершается 7-й период 118 элементом, синтез которого был осуществлен уже в этом столетии. Период полураспада его ничтожен. Размеры атома данного элемента теоретически должны быть больше размеров атома радона.
Краткий итог темы
1. Крайне важно знать, что атом представляет собой систему зарядов, противоположных по знаку (ядро и электроны).
2. Атом - чрезвычайно устойчивая динамическая система.
3. Электронное облако характеризует не образ «размытых» в пространстве электронов или электрона, а область вероятного местонахождения электронов относительно ядра.
4. Форма, пространственное расположение орбиталей и последовательность заполнения электронами энергетических уровней определяется квантовыми числами и квантовыми правилами.
5. Носителем свойств атомов является атомное ядро. Заряд ядра определяет количество электронов в электронейтральном атоме и, следовательно, характер распределения электронов по энергетическим уровням. Отсюда вытекают такие свойства атомов, как энергия ионизации, сродство к электрону, валентность, способность образовывать различные типы химических связей и их количество.
Термины для запоминания
Следует ориентироваться в физических и химических терминах и понятиях. Запоминание (знание) всегда должно следовать за пониманием. Если понятен смысл терминов и определений, их легче запомнить и применить в смежных областях знаний.
Проверьте свои знания. Лучший способ сделать это – записать определение термина или понятия своими словами, не заглядывая в текст. Термины и понятия не нужно заучивать наизусть, но передать их смысл близко к тексту необходимо. Если вы затрудняетесь в написании определения терминов и понятий – прочитайте соответствующий раздел темы еще раз.
Атом - это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра.