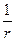Итак, атом - это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра.
Любое определение, включая и приведенное выше, отражает лишь ограниченное число свойств оригинала. Например, следует принять во внимание структуру ядра атома.
Ядро атома – это тоже микросистема, которая состоит из протонов и нейтронов. Число протонов определяет заряд ядра (Zя), а число нейтронов (N) в сумме с числом протонов выражают массовое число атома (А):
А = Z я + N
1.2. Взаимодействия в атомах
Энергия притяжения электронов к ядру, а также энергия движения электронов, стремящаяся оторвать электрон от атома, уравновешены, и атом сохраняет устойчивое состояние. Только воздействие внешней среды способно вывести атом из этого состояния. В роли внешней среды выступают микрочастицы вещества (атомы, молекулы, электроны) и поля (фотоны).
Рассмотрим атом водорода. По законам классической механики и электродинамики атом водорода – неустойчивая система. По законам квантовой механики, это устойчивая система, и сближение электрона с ядром не должно привести к его «падению» на ядро.
В 1927 г. В. Гейзенберг сформулировал действующий в квантовой механике принцип неопределенности: объект микромира невозможно одновременно с наперед заданной точностью характеризовать координатой и импульсом. Если неопределенность в определении координаты х составляет Dх, а неопределенность в определении импульса m u составляет D(m u), то неопределенности этих величин удовлетворяют условию (1.1)
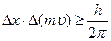 , (1.1)
, (1.1)
где m – масса; u – скорость микрочастицы, движущейся вдоль координаты х; h – постоянная Планка.
Уравнение (1.1) получило название соотношения неопределенности Гейзенберга.
Потенциальная энергия (Е) атома водорода складывается из кинетической энергии электрона (U):
U = 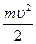
и энергии притяжения электрона ядром (V). Заряды ядра (в данном случае протона) и электрона равны по величине и противоположны по знаку (заряд е):
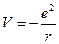
Е = U + V = 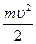
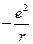 , (1.2)
, (1.2)
где u - скорость движения электрона массой m; r – радиус орбитали.
Состояние электрона с точно установленными значениями координаты r и импульса m u означало бы нарушение соотношения неопределенности Гейзенберга. Допустим, что неопределенность в определении координаты имеет порядок самой координаты (Dr » r), а неопределенность в определении импульса имеет порядок самого импульса (Dm u » m u). Согласно соотношению неопределенности получим:
r× m u = 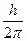 (1.3)
(1.3)
Подставляя значение u из уравнения (1.3) в выражение потенциальной энергии (1.2), получим:
Е = 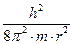
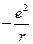 (1.4)
(1.4)
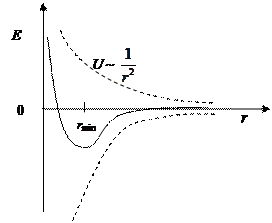
Устойчивому состоянию атома соответствует минимум потенциальной энергии 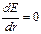 . Продифференцировав выражение (1.4) по r и приравняв
. Продифференцировав выражение (1.4) по r и приравняв 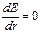 , получим:
, получим:
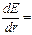 -
- 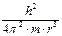 +
+ 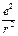 = 0.
= 0.
Отсюда 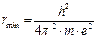 (1.5)
(1.5)
Полученное значение rmin совпадает с радиусом первой боровской орбиты атома водорода. Подставив rmin из уравнения (1.5) в уравнение (1.4), найдем энергию основного состояния атома водорода:
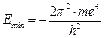
Эта величина соответствует минимальной энергии атома водорода (рис. 4).
 |

| ||||
 | ||||
1.3. Свойства атомов
Свойство – это качество, постоянно присущее объекту. Это качество проявляется не само по себе, а в отношении данного объекта с другим. Например, для того, чтобы атом проявлял свойство отдавать электроны, необходим партнер, способный принимать электроны. Такая картина повторяется при описании любых свойств. Поэтому свойство иногда называют «свернутым отношением», подразумевая, что результат отношения объектов приписываем одному из них в качестве свойства, «забывая» о другом объекте.
Атомы проявляют свойство обмениваться энергией с окружающей средой. Рассмотрим изменения энергетического состояния атома водорода при взаимодействии с электромагнитным излучением. Стационарное состояние атома соответствует положению электрона на низшем энергетическом уровне Е1. Переход электрона на более высокий энергетический уровень Е2 означает поглощение фотона (кванта электромагнитного излучения 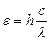 ) и переход атома в возбужденное состояние. В возбужденном состоянии атом пребывает крайне короткое время (~ 10-8 с). В соответствии с законом сохранения энергии возбужденный атом излучает квант поглощенной энергии и возвращается в устойчивое состояние. Квантовые переходы фиксируются приборами в виде линейчатых спектров атома водорода. Один из них представлен на рис. 5.
) и переход атома в возбужденное состояние. В возбужденном состоянии атом пребывает крайне короткое время (~ 10-8 с). В соответствии с законом сохранения энергии возбужденный атом излучает квант поглощенной энергии и возвращается в устойчивое состояние. Квантовые переходы фиксируются приборами в виде линейчатых спектров атома водорода. Один из них представлен на рис. 5.
 |
Рис. 5. Спектральная серия Бальмера в спектре атома водорода
Атомы проявляют свойство отдавать и присоединять электроны. Энергия, которую необходимо затратить, чтобы оторвать электрон от атома, называется энергией ионизации (Еи,кДж/моль), например:
Еи
Li ® Li+ + е-
Сродство атомов к электрону (Есэ, кДж/моль) характеризуется энергией, необходимой для отрыва электрона от соответствующего отрицательного иона (аниона), например:
Есэ
Cl- ® Cl + е-
Способность атомов участвовать в образовании химических связей включает в себя реакции образования и разрыва между атомами ковалентных, ионных или металлических связей:
H + H ® H2 (H-H ковалентная связь)
Li + F ® LiF (Li+F- ионная связь)
Cu2+ + 2e- ⇄ Cu0 (Cu0 отражает образование металлической связи)
1.4. Периодический закон Д.И. Менделеева. Квантовые законы
В современной интерпретации периодический закон может быть сформулирован так: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов. Закон был открыт Д. И. Менделеевым в 1869 г, когда о строении атомов и квантовой механике ученые ничего не знали. Периодическая система элементов есть табличное выражение квантовых законов.
В 1926 г. австрийский физик-теоретик Э. Шредингер разработал теорию движения микрочастиц – волновую механику, в основу которой положил уравнение, играющее такую же фундаментальную роль, как законы И. Ньютона в классической физике. Решением волнового уравнения Шредингера является функция 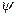 , которая удовлетворяет волновому уравнению при условии, что квантовые числа n , l , ml., физический смысл которых рассматривается ниже, принимают определенные значения.
, которая удовлетворяет волновому уравнению при условии, что квантовые числа n , l , ml., физический смысл которых рассматривается ниже, принимают определенные значения.
С позиций квантовой механики период – это горизонтальный ряд элементов, в атомах которых электроны последовательно заполняют ns - и завершают заполнение np - орбиталей (n – главное квантовое число, определяющее порядковый номер внешнего энергетического уровня и одновременно номер периода) (рис. 6). Группа – это вертикальный ряд, в котором объединены атомы химических элементов с одинаковым числом электронов на внешней орбитали.
Что такое квантовые числа?