Атом - это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра.
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального
образования
«Нижегородский государственный архитектурно-строительный университет»
В. А. Яблоков
Х И М И Я
Теоретические основы курса
Нижний Новгород
ННГАСУ
2009
ББК 24.1
Я 71
Рецензенты
чл.-корр. РАН, доктор хим. наук, проф. Гришин Д.Ф. (Нижегородский государственный университет им. Н. И. Лобачевского); доктор хим. наук, проф. Карташов В.Р. (Нижегородский государственный технический университет им. Р.Е. Алексеева).
Яблоков В. А.
Я 71 Химия. Теоретические основы курса [Текст]: учебное пособие /В. А. Яблоков, Нижегород. гос. архитектур.-строит. ун-т. – Н. Новгород: ННГАСУ, 2009. – 148 с.
ISBN 978-5-8114-0829-0
Теоретические основы курса химии являются первой частью учебного пособия, посвященного химическим знаниям. В нем изложены представления о строении атомов, молекул, кристаллических веществ, о типах химических связей. Рассмотрены физико-химические превращения вещества с позиций термодинамики и кинетики. Универсальность рассмотренных знаний – прекрасный инструмент применения теоретических основ химии в решении практических вопросов в различных сферах науки и техники.
Книга рассчитана на студентов технических специальностей.
ББК 24.1
Охраняется законом об авторском праве. Воспроизведение всей книги или любой ее части запрещается без письменного разрешения издателя.
Ó ННГАСУ, 2009
Ó В.А. Яблоков, 2009
ВВЕДЕНИЕ
Учебный материал пособия выстроен с использованием принципов системного анализа. Выделяются уровни организации вещества. Характеристики микро- (атомы, молекулы) и макросистем (твердые тела, жидкости, газы) рассматриваются в периодически повторяющейся последовательности (рис. 1).
В основе системного построения материала лежит идея о системности нашего мира и мыслительной деятельности человека.
Системой называется совокупность взаимосвязанных частей, выделенных из окружающей среды и выступающих по отношению к ней как целое.
Это одно из многих определений системы. В нашем случае курс химии является системой, выполняющей функцию средства достижения учебной цели.
Человек как мыслящая биосистема воспринимает и эффективно усваивает системно выстроенные знания, части которого находятся в определенных связях и отношениях. Чем подробнее представлены эти связи и отношения, тем выше уровень системности, тем полнее усваиваются знания. Достигается основная цель: формирование системы знаний, умений, навыков обучаемого, необходимых в профессиональной деятельности.
Приведённая на рис. 1 структура курса химии напоминает информационную паутину, в которой периодически наращиваются знания и по горизонтали и по вертикали от уровня к уровню. Связи и отношения существуют не только между блоками знаний, обозначенных в квадратах. Внутри каждого блока знаний имеются свои связи и отношения.
В каждом блоке предлагаются вопросы для проверки знаний и упражнения. Если возникают затруднения при ответах на вопросы, следует читать материал данной темы снова. Повторение имеет определенную направленность. Вы осознаете необходимость восстановления в памяти некоторых понятий и определений для формулировки ответов.
     | |||
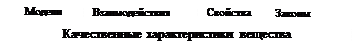 | |||
Рис. 1. Структура знаний высокого уровня системности
Химия – наука, изучающая состав, свойства и превращения вещества, а также явления, которые сопровождают эти превращения . Подразумеваются изменения, происходящие с множеством атомов и молекул в газе, жидкости или твердом теле. Химические превращения сопровождаются изменением физических свойств веществ. Изучением физико-химических превращений мы займемся в данном курсе.
ТЕМА 1
АТОМНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ ВЕЩЕСТВА
Все химические превращения в неживой и живой природе происходят на уровне атомов и молекул.
Атом состоит из заряженных частей. Подобно солнечной системе, он имеет центральную часть и окружение. Практически вся масса атома сосредоточена в ядре. Непрерывно движущиеся электроны охватывают громадную по сравнению с ядром область пространства. Если представить ядро атома водорода с горошину, то область движения электрона будет охватывать сферу радиусом более 100 м.
Атом - это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра.
Атом – микросистема, потому что реальный размер любого атома имеет порядок 10-10 м.
1.1. Модели атомов
Наши знания существуют в виде моделей. Модель есть объект-заменитель объекта-оригинала, сохраняющий некоторые его свойства. Существенными преимуществами модели перед оригиналом являются её доступность, обозримость, удобство в обращении.
Первой моделью атома можно считать модель греческого натурфилософа Демокрита (ок. 460 – 370 г. до н. э.). В его представлении атом – предел делимости всего сущего [др.-греч. atomoV неделимый]. Атомы невидимы из-за своих ничтожных размеров, не разрушаются и не гибнут, а по естественной необходимости образуют отдельные тела и весь мир с его множеством свойств.
Так силой ума, воображения была представлена умозрительная модель, которая просуществовала более двух тысячелетий и послужила хорошим основанием для поиска количественных характеристик неделимых микрочастиц.
Именно свойство неделимого атома было положено в основу определения относительных атомных масс химических элементов. Такое представление об атомах просуществовало вплоть до конца ХIХ в.
Первый шаг в раскрытии тайны строения атомов сделал английский физик Дж.Дж. Томсон (1856-1940), который в 1897 г. открыл электрон. Его масса оказалась в 1837 раз меньше массы атома водорода. Следовательно, атом делится на части, причем эти части заряжены. Электроны – отрицательно заряженные частицы. Положительно заряженная часть атома делает в целом атом электронейтральным.
Дальнейшие исследования вещества привели нобелевского лауреата, английского физика Э. Резерфорда (1871-1937) к созданию планетарной (ядерной) модели атома.
Экспериментальные доказательства такой модели у Э.Резерфорда были. Его молодой сотрудник Э. Марсден изучал движение потока положительно заряженных a-частиц сквозь тончайшую фольгу из золота и других металлов. Он обнаружил, что очень редко a-частицы отклонялись от прямолинейного движения сквозь фольгу, «отскакивали» от нее. Отскоки означали, что a-частицы «налетают» на массивные тела. Редкие отскоки означали, что массивные тела имеют ничтожно малые размеры и находятся на большом расстоянии друг от друга. Следовательно, атомы в металле устроены так, что их масса неравномерно распределена по всему объему атома. Положительно заряженные a-частицы могут отклоняться при своем движении только при сближении с положительно заряженной частью атома – ядром.
Но как удерживаются на расстоянии и не падают на ядро в результате притяжения отрицательно заряженные электроны? Ответа на этот вопрос Э. Резерфорд не знал. Вот что он писал в статье, опубликованной в 1911 г.: «Вопрос об устойчивости предлагаемого атома на этой стадии не следует подвергать рассмотрению. Устойчивость окажется, очевидно, зависящей от тонких деталей структуры атома и движения составляющих его заряженных частей».
По законам электростатики, чтобы сохранить устойчивость, электроны должны двигаться. По законам электродинамики, ускоренно двигаясь вокруг ядра, электроны должны излучать энергию и упасть на ядро. Получался замкнутый круг: движение электронов обеспечивает устойчивость, но оно же делает атом неустойчивым.
Теоретическое обоснование устойчивости атома дал в 1913 г. датский физик-теоретик Нильс Бор (1885-1962). Сущность его идеи заключалась в следующем. Спектры излучения возбужденных атомов (они по внешнему виду напоминают штрих-код на товаре) натолкнули его на идею о дискретности энергетических состояний атомов [лат. discretus разделенный, прерывистый]. Электроны «заселяют» энергетические уровни подобно тому, как это делают жильцы, заселяя квартиры на этажах многоквартирного дома (заметим, что между этажами никто не живет).
Законы, такого заселения еще не известны. Так рассуждал Бор. Если законы не известны – их следует искать. А пока можно сформулировать постулаты (утверждения, принимаемые за истинные, хотя и не доказанные), которые соответствуют тому факту, что атомы – устойчивые микросистемы. Постулаты Бора соответствовали квантовой модели водородоподобного атома и совершенно не согласовывались с представлениями классической физики:
в атоме существуют стационарные, разрешенные орбиты, двигаясь по которым, электроны не излучают энергию и не падают на ядро;
поглощение (или излучение) энергии атомом происходит только при переходе электрона с одной стационарной орбиты на другую.
Двадцатисемилетний Нильс Бор говорил о движении электронов по орбитам в поле ядра без потери энергии. Чем дальше от ядра расположены электроны, тем больше должна быть энергия движения электрона, противодействующая притяжению ядра. На вопрос, почему такие свойства проявляют движущиеся противоположно заряженные заряды, тогда можно было дать только один ответ: «так устроен мир микрочастиц».
В настоящее время доказано, что в атоме не существует траекторий, но есть область, где чаще или реже можно обнаружить движущиеся электроны. Это не орбита, а орбиталь – отрицательно заряженная область атома, в которой вероятность обнаружить движущийся электрон (или электроны) уменьшается по мере удаления от ядра.
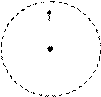
На рис. 2 представлены модели атомов водорода и гелия, а стрелками обозначено количество электронов на орбитали. Точками обозначено «электронное облако». Электронное облако - это не наглядный образ самого электрона или электронов, «размытых» в пространстве, а наглядное изображение области возможного местонахождения электронов по отношению к ядру. Пунктиром отмечена сферическая область - орбиталь, где сосредоточена подавляющая часть электронной плотности. Центральная точка – атомное ядро, стрелками обозначены спины электронов.
Электронное облако характеризует состояние движения электрона. Такое состояние движения напоминает движение футбольного вратаря. Чаще всего он находится в штрафной площадке, и чем дальше от ворот, тем меньше вероятность встретить его там. Но если движение вратаря во время матча все-таки можно изобразить некоторой траекторией, то для электрона такой возможности не существует в принципе.
 | |||||||
 | |||||||
| |||||||
| |||||||




Рис. 2. Модели атомов водорода и гелия
Уже будучи нобелевским лауреатом, Н. Бор часто с улыбкой вспоминал, как в 1950-х гг. к нему подошел после лекции студент и спросил: «Неужели действительно были такие идиоты, которые думали, что электрон вращается по орбите?».
В многоэлектронных атомах, кроме сферической s -орбитали, существуют p -орбитали (рис. 3), а также d - и f-орбитали, отличающиеся по форме и пространственному расположению.


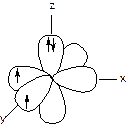
Рис. 3. Модель атома кислорода. Указаны 2рх, 2ру и 2рz-орбитали и спины электронов. Пунктиром обозначены 1s- и 2s-орбитали, но электронные пары на них не изображены








