Індивідуальні завдання до теми «Основні поняття і закони хімії»
| Варіанти | М (г/моль) | n (моль) | N (шт.) | V (л) | mречовини (г) | mмолекулыи(г) |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1 | + | 0,125 Сl2 | + | + | + | + |
| 2 | + | + | + | 0,5 Н2 | + | |
| 3 | + | + | 6,02×1020 О2 | + | + | + |
| 4 | + | + | + | - | 10 Fe | + |
| 5 | + | + | + | 3 О2 | + | + |
| 6 | + | + | 5×1010 | + | 2,7×10-12 | + |
| 7 | + | 0,1 | + | + | 6,4 | + |
| 8 | 80 | + | 3,01×1022 | + | + | + |
| 9 | + | + | + | - | 3,25 Zn | + |
| 10 | 44 | 0,2 | + | + | + | + |
| 11 | + | + | + | 10 СО2 | + | + |
| 12 | + | 5 | + | + | + | 3×10-23 |
| 13 | + | + | + | 2 | 2,8 | + |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 14 | 71 | + | + | + | 10 | + |
| 15 | + | + | + | 4 | + | 13,3×10-23 |
| 16 | + | 0,5 SO3 | + | + | + | + |
| 17 | + | + | + | 11,2 SO2 | + | + |
| 18 | + | + | + | + | 4,4 СО2 | + |
| 19 | + | + | 1,5×1020 | + | + | 1×10-22 |
| 20 | 30 | 4,5 | + | + | + | + |
| 21 | 2 | + | + | + | 6,7 | + |
| 22 | + | 15 | + | + | + | 5×10-23 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 23 | + | + | + | - | 10,7 Аg | + |
| 24 | 32 | + | + | + | 8 | + |
| 25 | + | + | + | 12 Сl2 | + | + |
П р и м і т к а :умова задачі приводиться в стовпцях 2-7. «+» – зазначена величина повинна бути обчислена, «-» - зазначена в стовпці величина не обчислюється або дані про неї відсутні.
Т а б л и ц я Д. 3.2.
Індивідуальні завдання до теми «Еквівалент»
| Варіан ти | Знайти еквівалентну масу речовин | Закон еквівалентів | |||
| Умова задачі | mэ | ||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1 | SO2 | H2S | Fe2(SO4)3 | 1,35 г МеО ® 3,15 г Ме(NO3)2 | MeO, Me |
| 2 | PbO2 | PbSO4 | H2PbO2 | 31,58% O2 в Ме2О3 | Ме2О3, Ме |
| 3 | Cr2O3 | CaCrO4 | K2Cr2O7 | 1,017 г МеО + 0,28 л Н2 ® | МеО, Ме |
| 4 | MnO2 | HmnO4 | Na2MnO4 | 0,943 г Н3РО4 + 1,291 г КОН ® | Н3РО4 |
| 5 | Cu2O | CuOHCl | Cu2S | Al(OH)3+2HCl®AlOHCl2+2H2O | Al(OH)3 |
| 6 | Cr(OH)3 | CrO3 | H2CrO4 | 20,06 г Ме ®21,66 г МеСln | MeCln |
| 7 | SO3 | Na2SO3 | H2S2O7 | 65,2% As в As2On | As, As2On |
| 8 | P2O5 | P2O3 | PH4Cl | 5,1 г Ме2О3+Н2®Ме+2,7 г Н2О | Ме2О3, Ме |
| 9 | CoS | [Co(NH3)6]Cl3 | Co(OH)3 | 13,8% S в Ме2S | Ме2S |
| 10 | Ni(OH)2 | Ni2O3 | NiOHNO3 | H3PO4+Ca(OH)2®CaHPO4+2H2O | H3PO4 |
| 11 | FeCl3 | Fe(HCO3)2 | FeO3 | 3,85 г Ме(NO3)n ® 1,16 г Ме(ОН)n | Me(OH)n |
| 12 | PtO | PtCl4 | H2[PtCl6] | 16,74 г Ме ® 21,54 г МеО | МеО,Ме |
| 13 | Co(OH)2 | CoOHBr | Co2O3 | 3,24 г Ме+2Н+® 4,03 л Н2+Ме3+ | Ме,МeCl3 |
| 14 | NaHCO3 | Na2CO3 | CO | 9,797 г Н3РО4+7,988 г NaOH ® | Н3РО4 |
| 15 | Cl2O7 | KClO3 | NaClO | 1,215 гМе+2Н+® 1,12 л Н2+Ме2+ | Ме,МеSO4 |
| 16 | CO2 | Ca(HCO3)2 | H2CO3 | 75,7%As в As2On | As, As2On |
| 17 | MnO3 | Mn(OH)2 | H2MnO3 | 1,5 гМе+0,69 л О2® | Ме,МеО |
| 18 | CaCr2O7 | HcrO2 | CrSO4 | 3,31 гМе(NO3)n® 2,78 г МеCln | Me |
| 19 | CaTiO3 | TiSO4 | TiO2 | 1,3 г Ме(ОН)3® 2,85 г Ме2 (SO4)3 | Ме(ОН)3,Me |
| 20 | AsH3 | H3AsO4 | Na3AsO3 | 2,48 г Ме2О ® 1,84 г Ме | Ме,Ме2О |
| 21 | Bi2O3 | Bi(OH)2Cl | NaBiO3 | 7,09 г МеО+ 2,24 л Н2®Ме+Н2О | МеО,Ме |
| 22 | HClO2 | NaClO3 | KClO4 | 79,78% хлору вМеCl3 | Me,MeCl3 |
| 23 | HIO3 | MgI2 | I2O | H3PO4+NaOH® NaH2PO4+H2O | H3PO4 |
| 24 | HBrO | AlBr3 | Ca(BrO3)2 | 7,2 г Ме®28,2 г МеCl2 | Ме, МеCl2 |
| 25 | H2Se | SeO2 | Na2SeO4 | Cr(OH)3+H2SO4® CrOHSO4+2H2O | Cr(OH)3 |
П р и м і т к а: знайти еквівалентну масу речовин, що містяться в стовпцях 2-4. Усі три речовини одного варіанта містять загальний елемент. Знайти еквівалентні маси цього елемента в кожній запропонованій речовині. У стовпці 6 зазначені хімічні формули речовин, еквівалентні маси яких повинні бути обчислені за законом еквівалентів.
Т а б л и ц я Д. 3.3.
Індивідуальні завдання до теми «Будова атома»
| Варіанти | Складіть електронно-графічні формули атомів і іонів | Укажіть набір квантових чисел : (n, l, ml, Sms ) для: | |||
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1 | 31Ga | 40Zr | S2- | Mg2+ | 4f8 |
| 2 | 55Cs | 16S | Si4+ | Si4- | 3d9 |
| 3 | 43Tc | 82Rb | Mn7+ | O2- | 5p5 |
| 4 | 21Sc | 34Se | Fe2+ | Cl- | 3s2 |
| 5 | 87Fr | 7N | Sn2+ | Br- | 2p2 |
| 6 | 46Pd (провал) | 57La | Ca2+ | I- | 5d7 |
| 7 | 39Y | 52Te | N3- | Cr3+ | 4s1 |
| 8 | 51Sb | 67Ho | Se6+ | Se2- | 3p6 |
| 9 | 26Fe | 48Cd | V2+ | V5+ | 6s1 |
| 10 | 76Os | 49In | Co2+ | F- | 5f14 |
| 11 | 79Au | 24Cr (провал) | Hg2+ | Li+ | 5s1 |
|
| |||||
| 12 | 42Mo (провал) | 82Pb | Gd3+ | Na+ | 3p4 |
| 13 | 83Bi | 53I | Sn4+ | Cl5+ | 7s2 |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 14 | 29Cu (провал) | 36Kr | As3+ | Se4+ | 5d5 |
| 15 | 4Be | 25Mn | Ti4+ | Al3+ | 4p3 |
| 16 | 11Na | 41Nb (провал) | V3+ | Sm3+ | 2p5 |
| 17 | 80Hg | 72Hf | W6+ | W2+ | 5d10 |
| 18 | 18Ar | 87Fr | La2+ | Cu2+ | 4d9 |
| 19 | 54Xe | 8O | C2+ | Au3+ | 6d3 |
| 20 | 101Md | 84Po | Ba2+ | Ag+ | 6p5 |
| 21 | 48Cd | 31Ga | Ge4+ | Sb3- | 6d2 |
| 22 | 86Rn | 89Ac | Mn4+ | As3- | 5p3 |
| 23 | 78Pt (провал) | 15P | Zn2+ | Zr4+ | 4s1 |
| 24 | 17Cl | 93Np | Si4- | P3- | 3d7 |
| 25 | 35Br | 105Ns | Bi5+ | Ga3+ | 1s1 |
Т а б л и ц я Д. 3.4.
Індивідуальні завдання до теми «Комплексні сполуки»
| Варіант | Комплексна сполука | Завдання |
| 1 | 2 | 3 |
| 1 | K2[Cu(CN)4] | 1. Назвіть комплексну сполуку |
| 2 | Na3[Co(CN)6] | |
| 3 | Fe3[Co(CN)6]2 | 2.Визначить іон-комплексоутворювач |
| 4 | [Ag(NH3)2]Br2 | |
| 5 | [Ag(CN)2]Cl | 3.Яка ступінь окиснення іона –комплексоутворювача? |
| 6 | [Co(NH3)6]Cl3 | |
| 7 | K4[Fe(CN)6] | 4. Назвіть ліганди, що входять до складу комплексної сполуки |
| 8 | K3[Fe(CN)6] | |
| 9 | [Cu(H2O)5]SO4 | 5. Визначіть координаційне число |
| 10 | [Zn(NH3)4](NO3)2 | |
| 11 | Na4[Cd(OH)6] | 6. Який заряд має комплексний іон? |
| 12 | [Ni(H2O)6]I2 | |
| 13 | K2[Zn(OH)4] | 7. Які іони утворюють зовнішню сферу? |
| 14 | [Cu(NH3)6]SO4 | |
| 15 | K2[Pt(OH)5Cl] | 8. Напишіть рівняння зовнішньосферної дисоціації |
| 16 | Na2[PdI4] | |
| 17 | (NH4)3[RhCl6] | 9. Напишіть рівняння вторинної дисоціації |
| 18 | [Pd(NH3)Cl]Cl | |
| 19 | [Co(NH3)5SO4]NO3 | 10. Складіть вираження константи нестійкості |
| 20 | K3[Cr(OH)6] | |
| 21 | Na2[HgJ4] | 11. Запропонуйте реакцію обміну за участю цієї солі |
| 22 | K[Ag(NO2)2] | |
| 23 | Na3[Ag(S2O3)2] | 12. До якого типу комплексних сполук відноситься? |
| 24 | K2[Cd(CN)4] | |
| 25 | [Co(H2O)2(NH3)2]Cl2 |
Т а б л и ц я Д. 3.5.
Варіанти індивідуальних завдань до теми “Енергетика хімічних процесів”
| Вар. | Рівняння реакції | Т | V | m | DH0 (m,v). | DH0р-ни | DH0 х.р. | DS х. р. | DG х.р. | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||
| 1 | Fe3O4(к)+CO(г)®3FeO(к)+CO2(г) | + | 5,6 СО2 | - | + | Fe3O4 | 34,6 | + | - | ||||
| 2 | C2H5OH(г)+3O2(г) ®2СО2(г)+3Н2О(ж) | 298 | 22,4 О2 | - | -469,8 | C2H5OH | + | + | + | ||||
| 3 | СО(г)+Н2О(г) ®СО2(г)+Н2(г) | 298 | - | 2,8 СО | + | - | + | + | + | ||||
| 4 | S®+3N2O ®SO3(г)+3N2(г) | 298 | - | 1,6 S | + | - | + | + | + | ||||
| 5 | NH3(г)+HCl(г)®NH4Cl(г) | 298 | 10 NH3 | - | + | + | + | + | + | ||||
| 6 | 2HI(г) ® I2(к)+Н2(г) | + | - | 5 Н2 | + | - | + | + | - | ||||
| 7 | СО(г)+3Н2(г) ® СН4(г)+Н2О(г) | 298 | 67,2 СН4 | - | + | - | + | + | + | ||||
| 8 | FeO(к)+СО(г) ® Fe(к)+СО2(г) | 298 | - | 16 FeO | + | - | + | + | + | ||||
| 9 | 2H2S(г)+СО2(г) ® H2O(г)+СS2(г) | + | - | 4,4 СО2 | + | СS2 | 65,4 | + | - | ||||
| 10 | 4NH3(г)+5О2(г) ® 4NO(г)+6Н2О(ж) | 298 | - | 17 NH3 | + | NO | -1168,8 | + | + | ||||
| 11 | 2NO(г)+О2(г) ®2NO2(г) | 298 | - | 8 О2 | + | - | + | + | + | ||||
| 12 | СН4(г)+Н2О(г) ® СО9(г)+3Н2(г) | + | - | 1,8Н2О | + | СН4 | 206,2 | + | - | ||||
| 13 | Fe3O4(к)+4CO(г)®3Fe(к)+4CO2(г) | 298 | 2,8СО | - | + | Fe3O4 | -14,9 | + | + | ||||
| 14 | 4HCl(г)+О2(г) ® 2Н2О+2Cl2(г) | 298 | 2,8 О2 | + | + | НСl | -114,4 | + | + | ||||
| 15 | 4NH3(г)+3О2(г) ® 2N2(г)+6Н2О(г) | 400 | 11,2 N2 | - | + | - | + | + | + | ||||
| 16 | N2(г)+3Н2(г) ® 2NH3(г) | + | 11,2 N2 | - | + | - | + | + | + | ||||
| 17 | CH4(г)+2О2(г) ® 2Н2О(г)+СО2(г) | 298 | - | 0,8 CH4 | + | CH4 | -890,3 | + | + | ||||
| 18 | СН3ОН(ж)+3/2O2®CO2(г)+2Н2О(ж) | 400 | СО2 | Н2О | -363,3 | - | + | + | + | ||||
| 19 | Fe2O3(к)+3CO(г)®2Fe(к)+3CO2(г) | 298 | 11,2 СО | - | + | + | + | + | + | ||||
| 20 | С6Н6(ж)+15/2O2(г) ® 3Н2О(г)+6СО2 | 298 | 1 СО2 | - | + | С6Н6 | -3135,6 | + | + | ||||
| 21 | С2Н2(г)+5/2O2® 2CO2(г)+Н2О(г) | 298 | О2 | С2Н2 | -100 | - | + | + | + | ||||
| 22 | N2(г)+3Н2(г) ®2NH3(г) | + | 22,4 NH3 | - | + | + | -92,4 | + | - | ||||
| 23 | 4NH3(г)+5О2® 4NO(г)+6Н2О(г) | 298 | - | 60 NO | + | - | + | + | + | ||||
| 24 | CO2(г)+С(к) ®2СО(г) | + | - | 6 С | + | - | + | + | - | ||||
| 25 | С®+2N2O(г) ®СО2(г)+2N2(г) | + | 11,2 N2O | - | + | N2O | -557,4 | + | - | ||||
П р и м і т к а : для зазначеної в кожнім варіанті реакції треба обчислити:
DН(m,V) (кДж) – ентальпія хімічної реакції, обчислена для запропонованої маси (ст.5) чи об¢єму (ст.4) речовини за стандартних умов;
DНреч-ни (кДж/моль) – стандартна ентальпія утворення речовини, зазначеного в ст. 7;
DНх.р.(кДж) – ентальпія хімічної реакції за стандартних умов;
DSх.р.(Дж/К) – ентропія хімічної реакції за стандартних умов;
DGт.(кДж) – енергія Гиббса (ізобарно-ізотермічний потенціал) хімічної реакції при температурі Т, зазначеної в ст.3. Температурною залежністю DНх.р і DSх.р від температури зневажити при обчисленні DGт.;
Т (К) – температура в градусах Кельвіна. Її розраховувати по рівнянню Гіббса-Гельмгольца для момента рівноваги: DGх.р.= 0;
m (г) – маса зазначеної речовини в грамах; V (л) – об¢єм зазначеної речовини (н.у.)
Т а б л и ц я Д. 3.6.
Індивідуальні завдання до теми «Швидкість хімічних реакцій і хімічна рівновага»
| Варіант | 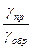
| t1 | t2 | 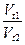
| 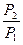
| 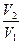
| 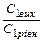
| 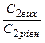
| 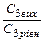
| 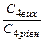
| Kp |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 1 | 3,2:2,8 | 308 | 358 | + | - | - | - | 0,3/+ | - | 0,0/+ | 0,4 |
| 2 | 3,0 | 320 | 300 | + | - | 0,5 | - | - | - | - | - |
| 3 | 2,5:2,2 | 405 | 425 | + | - | - | 0,5/+ | 0,4/+ | 0,0/+ | 0,0/+ | 1,0 |
| 4 | - | - | - | + | 2 | + | - | +/0,3 | 0,0/+ | 0,0/0,3 | + |
| 5 | 3 | 420 | 390 | + | 4 | - | - | - | - | - | - |
| 6 | - | - | - | + | + | 3 | 0,4/+ | - | 0,0/+ | - | 0,3 |
| 7 | 2,5:2,8 | 310 | 330 | + | - | 4 | - | - | - | - | - |
| 8 | - | - | - | + | 3 | + | - | 0,05/+ | - | 0,01/+ | 0,1 |
| 9 | - | - | - | + | - | 0,2 | +/0,6 | +/0,5 | 0,0/0,2 | 0,0/+ | + |
| 10 | 3,3:3 | 320 | 250 | + | 3 | - | - | - | - | - | - |
| 11 | 2,7 | 348 | 388 | + | - | - | +/0,6 | +/0,8 | 0,0/0,4 | - | - |
| 12 | - | - | - | + | + | 0,5 | +/0,2 | +/0,3 | 0,0/0,4 | 0,0/012 | + |
| 13 | 2,5:2,9 | 303 | 343 | + | 0,5 | - | - | - | - | - | - |
| 14 | - | - | - | + | + | 2 | +/0,3 | +/0,1 | 0,0/0,5 | 0,0/0,5 | + |
| 15 | - | - | - | + | - | 3 | +/0,8 | +/0,7 | 0,0/0,1 | 0,0/+ | + |
| 16 | - | - | - | + | 4 | + | +/0,6 | +/0,3 | -/0,1 | - | + |
| 17 | 3,5 | 370 | 400 | + | 0,3 | - | - | - | - | - | - |
| 18 | 2,2 | 620 | 640 | + | 0,5 | - | - | 0,8 | - | - | - |
| 19 | 2,5:3,0 | 400 | 430 | + | - | 3 | - | - | - | - | - |
| 20 | 3,0 | 500 | 470 | + | - | 2 | - | - | - | - | - |
| 21 | 3,0 | 400 | 380 | + | 1,5 | - | 0,5 | 0,2 | - | - | - |
| 22 | - | - | - | + | 5 | - | +/+ | +/0,6 | 0,0/0,18 | - | 0,1 |
| 23 | 3: 3,5 | 320 | 340 | + | 0,5 | - | - | - | - | - | - |
| 24 | - | - | - | _ | + | 2 | 0,9/+ | - | 0,0/0,3 | - | + |
| 25 | 2,2:2,5 | 500 | 530 | + | 3 | - | - | - | - | - | - |
П р и м і т к а : для зазначених у таблиці 5 хімічних реакцій відповідно до номера варіанта обчислити:
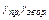 -температурні коефіцієнти відповідно прямій і зворотній реакції
-температурні коефіцієнти відповідно прямій і зворотній реакції
t1, t2 – початкову і кінцеву температуру хімічної реакції; Vt1, Vt2 – швидкості хімічних реакцій (прямої і зворотної) відповідно при температурах t1, t2;
Р1, Р2 – відповідно початковий і кінцевий тиск у судині, де протікає хімічна реакція;
V1, V2 –початковий і кінцевий об’єми реагуючих речовин;
С1(вих) С2(вих), С3(вих), С4(вих) – вихідні концентрації речовин (моль/л);
С1(р), С2(р), С3(р), С4(р) – рівноважні концентрації речовин (моль/л) – для оборотних реакцій, а для необоротних – концентрації в деякий момент часу;
Кр – константа рівноваги оборотної хімічної реакції при визначеній температурі;
Зрушення рівноваги (убік прямої або зворотної реакції) слід підтвердити відповідними розрахунками;
А + В Û С + Д; А + В Û С; А Û В + Д и т.д.
С1 +С2 С3+С4 С1 С2 С3 С1 С2 С3
Т а б л и ц я Д. 3.7.
Індивідуальні завдання до теми "Способи вираження концентрації розчинів"
| Варіант | Речовина | Концентрація водних розчинів | |||||||||
| mв-ва | mр-ра | Vр-ра | rр-ра | С % | Сн | Див | Див | N | T | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | |
| 1 | Al2(SO4)3 | 0,4 | 1,6 | + | 1,23 | + | + | + | + | + | + |
| 2 | CaCl2 | - | - | - | 1,18 | 20 | + | + | + | + | + |
| 3 | BaCl2 | + | 1,2 | + | 1,20 | + | 2,3 | + | + | + | + |
| 4 | Fe2(SO4)3 | + | 2,0 | + | 1,02 | + | + | 0,8 | + | + | + |
| 5 | H2SO4 | 1,2 | + | 2,0 | 1,34 | + | + | + | + | + | + |
| 6 | NaOH | + | + | 6,0 | 1,33 | 30 | + | + | + | + | + |
| 7 | H2SO4 | + | 2,4 | 2,0 | + | 27 | + | + | + | + | + |
| 8 | FeCl3 | + | 3,0 | + | 1,24 | + | + | + | 2,- | + | + |
| 9 | K2Cr2O7 | + | + | 0,3 | 1,06 | 8 | + | + | + | + | + |
| 10 | MgSO4 | + | 5,0 | + | 1,22 | + | 4,1 | + | + | + | + |
| 11 | K2CO3 | - | - | - | 1,19 | + | + | 1,5 | + | + | + |
| 12 | HNO3 | + | + | 4,0 | 1,12 | 21 | + | + | + | + | + |
| 13 | ZnSO4 | + | + | 2,5 | 1,38 | + | + | + | 2,3 | + | + |
| 14 | Na2CO3 | + | 4,0 | + | 1,03 | + | 0,5 | + | + | + | + |
| 15 | Na2SO4 | + | + | 3,0 | 1,06 | + | + | 0,5 | + | + | + |
| 16 | AlCl3 | - | - | - | 1,15 | 16 | + | + | + | + | + |
| 17 | CuSO4 | 0,2 | 2,2 | + | 1,11 | + | + | + | + | + | + |
| 18 | AgNO3 | + | + | 1,5 | 1,32 | + | + | + | 2,5 | + | + |
| 19 | K2SO4 | + | + | 3,0 | 1,08 | + | + | 0,6 | + | + | + |
| 20 | HNO3 | - | - | - | 1,25 | + | 8,0 | + | + | + | + |
| 21 | NH4Cl | 0,2 | 1,0 | + | 1,06 | + | + | + | + | + | + |
| 22 | FeSO4 | + | 0,5 | + | 1,10 | + | + | + | 0,7 | + | + |
| 23 | HCl | + | + | 0,2 | 1,05 | 10 | + | + | + | + | + |
| 24 | Pb(NO3)2 | - | - | - | 1,09 | + | 0,7 | + | + | + | + |
| 25 | KMnO4 | + | 1,5 | + | 1,04 | + | + | 0,4 | + | + | + |
П р и м і т к а : по наявним даним у таблиці 6 обчислити всі інші концентрації.
mреч. (кг) – маса розчиненої речовини, хімічна формула якого приведена в ст.1.
mр-ну (кг) – маса водного розчину цієї речовини.
Vр-ну (л) – об¢єм розчину.
rр-ру (кг/л) – густина розчину.
С % - масова частка розчиненої речовини (процентна концентрація).
Сн (моль/л) – еквівалентна (нормальна) концентрація розчиненої речовини.
СМ (моль/л) – молярна концентрація розчиненої речовини.
Сm (моль/кг) - моляльна концентрація розчиненої речовини.
N – мольна частка розчиненої речовини
Т (г/мл) – титр розчиненої речовини.
Не слід плутати (r речовини і Т речовини. Густина – це маса 1 мл розчину в грамах, а титр – це кількість розчиненої речовини в грамах, що містяться в 1 мл розчину.
Таблиця Д.3.8
Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
| Ва рі ант | Речовина | Електролітична дисоціація. рН розчинів | Гідроліз солей | ||||||
| СМ | рН | 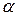
| Кд | С 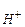
| С 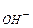
| рОН | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 1 | СН3СООН | 1,0 | + | 0,42 | + | + | + | + | Na2S, NH4Cl |
| 2 | H2SO4 | + | + | 46,0 | - | 3,68×10-1 | + | + | CuSO4, K2SO4 |
| 4 | H2S | + | + | 0,07 | + | + | 1,43×10-8 | + | CH3COONa Co(NO3)2 |
| 5 | СН3СООН | + | + | 1,34 | + | + | + | 8,8 | NiCl2, Ca(HCO3)2 |
| 6 | H2SO3 | 0,08 | 2,4 | + | + | + | + | + | CuOHCl, Na2SO3 |
| 7 | H2CO3 | 0,1 | + | + | + | + | + | 10,02 | NaHCO3, CuCl2 |
| 8 | HNO3 | + | + | 82,0 | - | + | 1,22×10-12 | + | FeCl3, Li2S |
| 9 | HCOOH | + | + | 2,0 | 1,77×10-4 | + | + | + | Mg(HCO3)2 SnCl2 |
| 10 | СН3СООН | 0,1 | + | + | 1,10-5 | + | + | + | KCN, FeSO4 |
| 11 | HCN | + | 5,15 | 0,01 | + | + | + | + | CrCl3, K2S |
| 12 | H2S | 0,1 | 6,12 | + | + | + | + | + | Pb(NO3)2, NaCN |
| 14 | HNO3 | 1,1 | + | + | - | 9,02×10-1 | + | + | AlCl3, Li2CO3 |
| 15 | HNO2 | + | 4,4 | + | 4×10-4 | + | + | + | Cr2(SO4)3, NaNO2 |
| 16 | NaOH | + | + | 80,0 | - | 7,2×10-1 | + | + | HCOONa, (NH4)2S |
| 17 | NH4OH | 0,1 | + | + | + | + | 1,33.10-3 | + | CrCl3, CH3COOK |
| 18 | H2SO4 | 0,5 | + | + | + | 2,55.10-1 | + | + | Ba(NO3)2, Fe2(SO4)3 |
| 19 | CH3COOH | + | + | + | 1,7.10-5 | 4,25.10-2 | + | + | KH2PO4, Cr(NO3)3 |
| 20 | HCN | 0,1 | + | + | 4,9.10-10 | + | + | + | Ni(NO3)2, (NH4)2CO3 |
| 21 | H3PO4 | + | + | + | 7,11.10-3 | + | + | 12,74 | Ba(HCO3)2, Fe(NO3)3 |
| 23 | H3BO3 | + | + | + | 5,83.10-10 | + | + | 10,32 | Pb(CH3COO)2 Pb(NO3)2 |
| 24 | H2CO3 | + | + | + | 4,45.10-7 | + | 0,6.10-10 | + | CaHPO4, LiCN |
| 25 | NH4OH | + | + | + | 1,8.10-5 | + | + | 2,38 | NH4NO3, Li2SO3 |
П р и м і т к а: для слабких електролітів усі розрахунки робити тільки для першої ступіні дисоціації; a у розрахункових формулах брати в частках одиниці; рН - водневий показник розчину речовини, зазначеного в ст.12. Молярна концентрація розчину зазначена в ст.13.
a % - ступінь електролітичної дисоціації зазначеної речовини в розчині з концентрацією СМ.
К1 – константа електролітичної дисоціації цієї речовини у водному розчині по першій ступіні дисоціації.
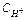 (моль/л) – концентрація іонів Н+ в даному розчині.
(моль/л) – концентрація іонів Н+ в даному розчині.
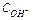 (моль/л) – концентрація іонів ОН- у даному розчині.
(моль/л) – концентрація іонів ОН- у даному розчині.
рОН – гідроксильний показник розчину даної речовини.
Хімічні рівняння гідролізу зазначених солей (ст.20) слід написати в молекулярному й іонному видах по I ступіні (співвідношення речовини і води – 1 моль: 1 моль). Указати реакцію середовища, що виходить при гідролізі кожної речовини.
Т а б л и ц я Д. 3.9.
Індивідуальні завдання до теми "Окисно-відновні реакції". "Гальванічні елементи"
| Варіанти | Окисно-відновні реакції | Гальванічні елементи | |||
| Система електродів | СА | СК | Е.Р.С. | ||
| 1 | 2 | 3 | 4 | 5 | |
| 1 | K2Cr2O7 +HCl® Cl2+ CrCl3 + … | Cu2+/Cu0; Ag+/Ag0 | 10-1 | + | 0,31 |
| 2 | Mn+ HNO3(p) ® Mn(NO3)2+ N2O + … | Fe3+/Fe0; Cr3+/Cr0 | 1,0 | 10-3 | + |
| 3 | FeSO4+KClO3+H2SO4 ®Fe2(SO4)3+KCl+… | Sn2+/Sn0; Sn2+/Sn0 | 10-1 | 10-4 | + |
| 4 | KMnO4+KNO2+H2SO4®MnSO4+KNO3+… | 2H+/H20; Ni2+/Ni0 | + | 10-2 | 0,34 |
| 5 | Zn+KMnO4+H2SO4®ZnSO4+MnSO4+ … | Au3+/Au0; Fe2+/Fe0 | 0,5 | 10-2 | + |
| 6 | K2Cr2O7+H2S+H2SO4®S+Cr2(SO4)3+ +… | Bi3+/Bi0; Zn2+/Zn0 | 10-2 | + | 0,995 |
| 7 | MnSO4+PbO2+HNO3®HMnO4+ … | Mn2+/Mn0; 2H+/H20 | + | 1,0 | 1,3 |
| 8 | NaCrO2+Br2+NaOH®Na2CrO4+NaBr+… | Ag+/Ag0 ; Ag+/Ag0 | 10-1 | 10-3 | + |
| 10 | H3AsO3+ KMnO4+H2SO4®H3AsO4+MnSO4+… | Al3+/Al0; Sn2+/Sn0 | 10-1 | 1,5 | + |
| 11 | Ca+HNO3® NH4NO3+ … | Pb2+/Pb0; Cu2+/Cu0 | + | 2,0 | 0,17 |
| 12 | Cr2O3+KClO3+KOH®K2CrO4+KCl+… | V2+/V0; Cd2+/Cd0 | 0,5 | 0,3 | + |
| 13 | KMnO4+HBr®Br2+MnBr2+… | Co2+/Co0; 2H+/H20 | 10-2 | + | 0,397 |
| 14 | As3+HNO3(к) ®H3As4+NO2+… | Al3+/Al0;Al3+/Al0 | 1,5 | 10-2 | + |
| 15 | Ag+H2SO4(к) ®SO2+ … | Sn2+/Sn0; Zn2+/Zn0 | 10-2 | 10-3 | + |
| 16 | FeS+HNO3(p) ®Fe(NO3)2+S+NO+ … | Cr3+/Cr0; Ag+/Ag0 | 10-2 | 10-4 | + |
| 17 | KMnO4+Na2SO3+KOH®K2MnO4+Na2SO4+… | Al3+/Al0; 2H+/H20 | 0,5 | 10-3 | + |
| 18 | KMnO4+NaI+H2O®I2+MnO2+ … | Cu2+/Cu0 ; Cu2+/Cu0 | 2,0 | 10-5 | + |
| 19 | Mg+H2SO4®H2S + … | 2H+/H20 ; Ag+/Ag0 | + | 10-1 | 0,86 |
| 20 | K2Cr2O7+H3PO3+H2SO4®Cr2(SO4)3+H3PO4+… | Al3+/Al0; Cu2+/Cu0 | 0,6 | 10-1 | + |
| 21 | P+HNO3+H2O®H3PO4+NO | Fe3+/Fe0; 2H+/H20 | + | 1,0 | 0,097 |
| 22 | KMnO4+Na2S+H2O®MnO2+S+ … | Pb2+/Pb0 ; Pb2+/Pb0 | 1,0 | 10-3 | + |
| 23 | Na3[Cr(OH)6]+H2O2®Na2CrO4+ … | Co2+/Co0 ; Al3+/Al0 | 10-3 | + | 0,793 |
| 24 | Al+HNO3(p) ®N2+ … | Ti2+/Ti0; 2H+/H20 | 10-1 | 2 | + |
| 25 | K2Cr2O7+HCl+SnCl2®CrCl3+SnCl4+… | Cr3+/Cr0 ; Cr3+/Cr0 | 10-2 | 10-4 | + |
П р и м і т к а : у ст.1 приведена схема ОВР. Необхідно закінчити рівняння хімічної реакції і підібрати коефіцієнти методом електронного балансу або методом напівреакцій.
По темі: "Гальванічні елементи" треба скласти схему елемента (ГЕ) із зазначеною системою електродів (ст.2). Описати роботу ГЕ, вказавши анод, катод, зовнішій і внутрішній ланцюги. Написати процеси окислення, відновлення і знайти сумарну хімічну реакцію, що протікає в процесі роботи ГЕ. Розрахувати Е.Р.С. ГЕ в стандартних умовах. Вирішити задачу, використовуючи дані ст. 3,4,5.
СА (моль/л) – молярна концентрація електроліту в анодному просторі.
СК (моль/л) – молярна концентрація електроліту в катодному просторі.
Е.Р.С. (В) – електрорушійна сила ГЕ.
Т а б л и ц я Д. 3.10.
Індивідуальні завдання до теми "Електроліз"
| Варі-ант | Речовина | Електроліз водных розчинів | |||||||
| К | Q | I | t | mр-ни | Vр-ни | h | М | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 1 | K2SO4 | - | 15,0 | - | - | H2O | O2, H2 | 95 | - |
| 2 | CrCl3 | Cr | + | 1,8 | 1,5 | Cr | Cl2 | 85 | - |
| 3 | CuSO4 | Cu | + | - | - | Cu | 0,16 л О2 | 90 | - |
| 4 | Na2SO4 | - | 35,0 | - | - | H2O | Н2, О2 | 70 | - |
| 5 | AgNO3 | Ag | 8,0 | + | 4 | Ag | О2 | 80 | - |
| 6 | Cu(NO3)2 | Cu | + | 50 | 4 | 224 г Cu | О2 | + | - |
| 7 | MeSO4 | Me | + | 6 | 0,75 | 5,49 г Me | О2 | 100 | Me |
| 8 | LiCl | Li | + | - | - | H2O | 0,476 л Cl2 | 85 | - |
| 10 | NaI | - | 15,0 | - | - | 4,7 г H2O | Н2 | + | - |
| 11 | MeCl3 | Me | + | 1,5 | 0,5 | 1,071 г Me | Cl2 | 100 | Me |
| 13 | Na2SO4 | - | + | 1,0 | + | H2SO4,NaOH | 0,448 л Н2 | 80 | - |
| 14 | CuSO4 | Cu | + | 2,5 | 0,25 | 0,72 г Cu | О2 | + | - |
| 15 | MeSO4 | Me | 0,95 | - | - | 1,595 г Ме | О2 | 80 | Me |
| 16 | KBr | - | + | 15 | 1,6 | 48 г KOH | H2 
| + | - |
| 17 | ZnSO4 | Zn | + | + | 10,0 | 500 г Zn | O2 | 85 | - |
| 18 | FeCl2 | Fe | + | - | - | 200 г Fe | Cl2 | 70 | - |
| 19 | Cr2(SO4)3 | Cr | + | 2.104 | 1,0 | Cr, H2SO4 | O2 | 85 | - |
| 20 | MeCl2 | Me | + | 2 | 0,67 | 4,54 г Ме | Cl2 | 100 | Me |
| 21 | CuCl2 | Cu | + | 25 | 4 | 112 г Cu | Cl2 | + | - |
| 22 | H2O | - | + | 2 | + | 18 г Н2О | H2, O2 | 70 | - |
| 23 | MgCl2 | Mg | 2423 | - | - | Mg(OH)2 | 1000 л Cl2 | + | - |
| 24 | ZnCl2 | Zn | + | 1,5 | + | 13,6 г ZnCl2 | Cl2 | 90,5 | - |
| 25 | MeCl4 | Me | + | 2,5 | 0,33 | 1,35 г Ме | Cl2 | 90 | Me |
П р и м і т к а : спочатку необхідно написати схему електролізу водного розчину речовини, зазначеного в ст.1. Описати всі катодні, анодні процеси і знайти сумарну хімічну реакцію, що протікає під дією струму. Потім приступити до рішення задачі, умову якої приведено в ст.2-9.
К (г/(А. год) – електрохімічний еквівалент елемента,
Q (А. год) – кількість електрики, що пройшло через розчин,
I (А) – сила струму,
t (ч) – час електролізу,
mреч-ни (г) – маса речовини, якщо маса не дана, то розрахунки слід виконувати для речовини, зазначеної в ст.7.
Vреч-ни (л) – об¢єм речовини, який слід обчислити, якщо зведення про нього відсутні (ст.7),
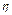 % - вихід по струму,
% - вихід по струму,
М (г/моль) – молярна маса металу.
Індивідуальні завдання до теми «Корозія і захист металів від корозії»
Два метали, що з’єднані між собою, знаходяться в різних середовищах: а) в кислому, б) в нейтральному або слаболужному. Згідно з варіантом складіть хімічні рівняння, що характеризують електрохімічну корозію запропонованої пари металів в цих середовищах. Розрахуйте Е.Р.С. для стандартних умов.
Т а б л и ц я Д.3.11
1) Zn/Al 6) Ni/Cu 11) Zn/Cu 16) Al/ Cu 21) Sn/Pb
2) Pb/Fe 7) Cr/Fe 12) Al/Zn 17) Al/Ag 22) Cr/Cu
3) Cu/Zn 8) Cu/Ag 13) Ni/Fe 18) Cd/Ni 23) Ag/Fe
4) Cd/Zn 9) V/Ti 14) Ti/Al 19) Pb/Ag 24) Ti/Zn
5) Co/Al 10) Mn/Co 15) Sn/Cr 20) Mg/Co 25) Al/Mn
ЗМІСТ
Вступ………………...…………………………………............................................................3
М о д у л ь 1. Основні поняття і закони хімії……………………………..………......... 4








