Питання до колоквіуму за темами
«Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
1. Основні уявлення про будову атомів.
2. Атомні ядра, їх склад. Ізотопи, ізобари, ізотони.
3. Моделі атома Томсона, Резерфорда, Бора.
4. Квантовомеханічна модель атома. Квантові числа; типи електронних орбіталей.
5. Порядок заповнення електронних рівнів і підрівнів багатоелектронних атомів(принцип мінімума енергії, принцип заборони Паулі, правило Хунда, правила Клечковського).
6. Електронні формули елементів.
7. Енергія іонізації і спорідненість до електрона. Электронегативність.
8. Періодична зміна властивостей хімічних елементів.
9. Періодичний закон і періодична система елементів Д.І.Менделєєва.
10. Сучасне формулювання періодичного закону.
11. Загальні уявлення про хімічний зв'язок. Види хімічного зв'язку. Спрямованість і насичуваність ковалентного зв'язку.
12. Ковалентний зв'язок, механізм його утворення.
13. Гібридизація атомних орбіталей, типи гібридизації.
14. Орієнтація атомних орбіталей, просторова структура молекул.
15. Полярність зв'язку і полярність молекули. Дипольний момент як міра полярності.
16. Довжина і міцність хімічного зв'язку. Енергія зв'язку. Спрямованість і насичуваність ковалентного зв'язку.
17. Іонний зв'язок, його особливості.
18. Донорно-акцепторний механізм утворення зв'язку.
19. Будова комплексних сполук, їхня класифікація.
20. Стійкість комплексів у розчинах. Константа дисоціації. Подвійні солі.
21. Металевий зв'язок.
22. Водневий зв'язок, його різновиди.
23. Агрегатні стани речовин.
24. Взаємодія між молекулами. Орієнтаціонний, індукційний і дисперсійний ефекти.
25. Будова кристалів. Рідиннокристалічний стан.
26. Хімічний зв'язок у кристалах. Молекулярні, ковалентні й іонні кристали.
27. Залежність фізичних властивостей від виду хімічного зв'язку в кристалах.
28. Металеві кристали. Дефекти кристалічних ґрат.
29. Рідкий стан речовин; міжмолекулярний зв'язок. Будова рідкої води.
30. Аморфний стан.
Питання до колоквіуму по темах «Електрохімічні процеси. Корозія і захист металів від корозії»
1. Гетерогенні окисно-відновні процеси. Гальванічні елементи.
2. Поняття про електродні потенціали.
3. Залежність електродних потенціалів від різних факторів. Формула Нернста.
4. Вимір електродних потенціалів. Водневий електрод.
5. Стандартні електродні потенціали. Ряд напруг металів.
6. Необоротні гальванічні елементи Вольта, Даніеля-Якобі, Лекланше. Хімічні джерела струму.
7. Розрахунок електрорушійної сили гальванічних елементів.
8. Концентраційні елементи. Паливні елементи.
9. Оборотні гальванічні елементи. Кислотні і лужні акумулятори.
10. Сутність електролізу.
11. Потенціал розкладання, його розрахунок.
12. Послідовність розрядки іонів на катоді й аноді.
13. Особливості електролізу водних розчинів електролітів.
14. Електроліз з нерозчинними і розчинними анодами.
15. Вторинні процеси при електролізі. Явище перенапруги.
16. Кількісні співвідношення при електролізі. Закони Фарадея.
17. Реальні електрохімічні процеси. Вихід по струму.
18. Електроліз розплавів.
19. Основи гальванічних методів нанесення металевих покрить.
20. Електролітичне одержання і рафінування технічних металів.
21. Одержання активних металів і лугів електролізом.
22. Основні причини корозії металів.
23. Класифікація корозійних процесів.
24. Хімічна корозія і її різновиди – газова, рідинна.
25. Закони росту оксидних плівок на поверхні металів.
26. Механізм електрохімічної корозії. Контактна корозія.
27. Корозія металів з водневою і кисневою деполяризацією.
28. Концентраційна корозія.
29. Корозія під дією блукаючих струмів.
30. Вплив середовища на швидкість протікання корозії.
31. Класифікація методів захисту металів від корозії.
32. Інгібітори корозії.
33. Антикорозійні покриття, методи їхнього нанесення.
34. Анодні і катодні покриття.
35. Протектори, механізм їхньої дії.
36. Хімічна модифікація поверхні металів.
37. Анодний і катодний захист.
Д о д а т о к 2
Т а б л и ц я Д 2.1
Тиск водяної пари при різних температурах
| Температура, ˚С | Тиск, кПа/мм рт.ст | Температура, ˚С | Тиск, кПа/мм рт.ст. | Температура, ˚С | Тиск, кПа/мм рт.ст. |
| 14 15 16 17 18 | 1,598/12,0 1,705/12,8 1,817/13,6 1,935/14,5 2,061/15,5 | 19 20 21 22 23 | 2,189/16,5 2,339/17,5 2,486/18,6 2,643/19,8 2,841/21,1 | 24 25 26 27 28 | 2,902/22,4 3,170/23,8 3,362/25,2 3,561/26,7 3,779/28,4 |
Т а б л и ц я Д 2.2
Відносна електронегативність елементів ( χ ) по Л. Полінгу
|
Групи
| |||||||
| I | II | III | IV | V | VI | VII | VIII |
| H 2,1 | |||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | |
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Co; Ni 1,9; 1,9 |
| Zn 1,6 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 | ||
| Pb 0,8 | Sr 1,0 | Y 1,2 | Zn 1,5 | Nb 1,6 | Mo 1,8 | Te 1,8 | Ru; Rh; Pd 2,2; 2,2; 2 |
| Cd 1,7 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 | ||
| Cs 0,7 | Ba 0,9 | La – Lu 1,0 – 1,2 | Hg 1,3 | Ta 1,5 | W 1,7 | Re 1,9 | Os; Ir; Pt 2,2; 2,2; 2,2 |
| Hg 1,9 | Pb 1,9 | Bi 1,9 | Po 2,0 | At 2,2 | |||
| Fr 0,7 | Ra 0,9 | ||||||
Т а б л и ц я Д. 2.3
Константи нестійкості (Кн) деяких комплексних іонів
| Схема дисоціації іона | Кн | РК |
| Галогеніди | ||
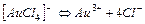
| 5,0×10-22 | 21,30 |
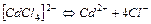
| 9,3×10-3 | 2,0 |
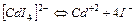
| 7,9×10-7 | 6,10 |
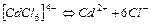
| 2,6×10-3 | 2,58 |
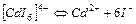
| 1,0×10-6 | 6,00 |
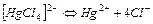
| 6,03×10-16 | 15,22 |
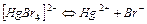
| 1,0×10-21 | 21,00 |
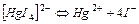
| 1,38×10-30 | 29,86 |
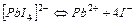
| 1,42×10-4 | 3,85 |
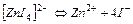
| 220,0 | -2,34 |
| Роданіди | ||
| Схема дисоціації | Кдисс | РК |
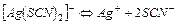
| 2,7×10-8 | 7,57 |
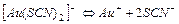
| 1,0×10-23 | 23,0 |
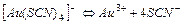
| 1,0×10-42 | 42,00 |
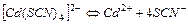
| 1,67×10-2 | 1,78 |
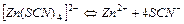
| 5,0×10-2 | 1,30 |
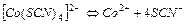
| 5,5×10-3 | 2,26 |
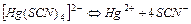
| 1,29×10-22 | 21,89 |
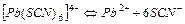
| 20 | -0,30 |
| Ціаніди | ||
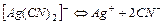
| 1,0×10-21 | 21,00 |
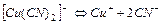
| 1,0×10-24 | 24,00 |
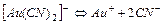
| 5,0×10-39 | 38,30 |
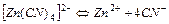
| 1,0×10-16 | 16,00 |
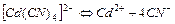
| 7,66×10-18 | 17,11 |
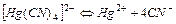
| 3,02×10-42 | 41,52 |
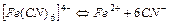
| 1,0×10-24 | 24,00 |
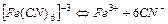
| 1,0×10-31 | 31,00 |
| Аміакати | ||
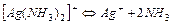
| 5,89×10-8 | 7,23 |
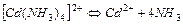
| 2,75×10-7 | 6,56 |
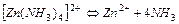
| 2,0×10-9 | 8,01 |
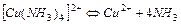
| 9,33×10-13 | 12,03 |
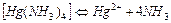
| 5,3×10-20 | 19,28 |
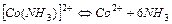
| 4,07×10-5 | 4,39 |
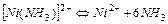
| 9,77×10-9 | 8,01 |
| Гідроксокомплекси | ||
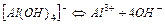
| 1,0×10-33 | 33,00 |
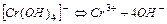
| 1,26×10-30 | 29,00 |
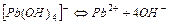
| 5,0×10-12 | 11,30 |
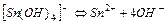
| 7,4×10-26 | 25,13 |
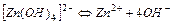
| 2,2×10-15 | 14,66 |
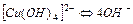
| 3,2×10-19 | 18,50 |
| Комплекси з трилоном Б (Edta) | ||
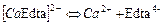
| 2,69×10-11 | 10,57 |
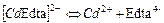
| 2,57×10-17 | 16,59 |
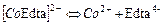
| 6,17×10-17 | 16,21 |
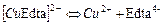
| 1,58×10-19 | 18,80 |
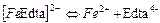
| 4,68×10-15 | 14,33 |
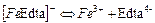
| 7,98×10-26 | 25,10 |
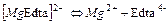
| 2,04×10-9 | 8,69 |
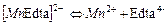
| 9,12×10-15 | 14,04 |
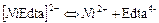
| 2,40×10-19 | 18,62 |
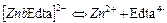
| 3,16×10-17 | 16,50 |
| Комплекси з оксалатами-іонами С2О42- (Ох2-) | ||
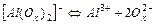
| 1,0×10-13 | 13,00 |
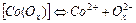
| 2,0×10-5 | 4,70 |
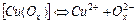
| 6,92×10-7 | 6,16 |
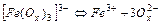
| 6,3×10-21 | 20,20 |
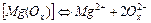
| 3,72×10-4 | 3,43 |
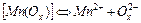
| 1,51×10-4 | 3,82 |
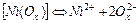
| 5,0×10-6 | 5,30 |
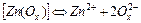
| 1,0×10-5 | 5,00 |
Т а б л и ц я Д. 2.4
Термодинамічні константи деяких речовин
| Речовина | ∆ H °298, кДж/моль | ∆ G °298, кДж/моль | S °298, Дж/(моль . К) |
| Al (к) | 0 | 0 | 28,31 |
| Al2O3 (к) | -1675,0 | -1576,4 | 50,94 |
| B (к) | 0 | 0 | 5,87 |
| B2O3 (к) | -1264,0 | -1184,0 | 53,85 |
| B2H6 (г) | 31,4 | 82,8 | 232,9 |
| Ba (к) | 0 | 0 | 64,9 |
| BaCO3 (к) | -1202,0 | -1138,8 | 112,1 |
| Be (к) | 0 | 0 | 9,54 |
| BeO (к) | -598,7 | -581,6 | 14,10 |
| BeCO3 (к) | -981,57 | -944,75 | 199,4 |
| C (алмаз) | 1,897 | 2,866 | 2,38 |
| C (графит) | 0 | 0 | 5,74 |
| CO (г) | -110,5 | -137,27 | 197,4 |
| CO2 (г) | -393,51 | -394,38 | 213,6 |
| C2H2 (г) | 226,75 | 209,2 | 200,8 |
| C2H4 (г) | 52,28 | 68,12 | 219,4 |
| CH4 (г) | -74,85 | -50,79 | 186,19 |
| C2H6 (г) | -84,67 | -32,89 | 229,5 |
| C6H6 (ж) | 49,04 | 124,50 | 173,2 |
| CH3OH (ж) | -238,7 | -166,31 | 126,7 |
| C2H5OH (ж) | -227,6 | -174,77 | 160,7 |
| Ca (к) | 0 | 0 | 41,62 |
| CaO (к) | -635,1 | -604,2 | 39,7 |
| Ca(OH)2 (к) | -986,2 | -896,76 | 83,4 |
| CaCO3 (к) | -1206,0 | -1128,8 | 92,9 |
| Cl2 (г) | 0 | 0 | 223,0 |
| HCl (г) | -92,30 | -95,27 | 186,7 |
| HCl (ж) | -167,5 | -131,2 | 55,2 |
| Cr (к) | 0 | 0 | 23,76 |
| Cr2O3 (к) | -1141,0 | -1046,84 | 81,1 |
| Cu (к) | 0 | 0 | 33,3 |
| Cu2O (к) | -167,36 | -146,36 | 93,93 |
| CuO (к) | -165,3 | -127,19 | 42,64 |
| Cu(OH)2 (к) | -443,9 | -356,90 | 79,50 |
| Cu(NO3)2 (к) | -307,11 | -114,22 | 193 |
| Fe (к) | 0 | 0 | 27,15 |
| FeO (к) | -263,68 | -244,35 | 58,79 |
| FeCl2 | -341,0 | -302,08 | 119,66 |
| Fe2O3 (к) | -821,32 | -740,99 | 89,96 |
| FeCl3 (к) | -405,0 | -336,39 | 130,1 |
| FeCO3 (к) | -744,75 | -637,88 | 92,9 |
| H2 (г) | 0 | 0 | 130,6 |
| H2O (г) | -241,84 | -228,8 | 188,74 |
| H2O (ж) | -285,84 | -237,5 | 69,96 |
| MgO (к) | -601,24 | -569,6 | 26,94 |
| MgCO3 | -1096,21 | -1029,3 | 65,69 |
| N2 (г) | 0 | 0 | 191,5 |
| N2O (г) | 81,55 | 103,6 | 220,0 |
| NO (г) | 90,37 | 86,69 | 210,62 |
| NO2 (г) | 33,89 | 51,84 | 240,45 |
| N2O4 (г) | 9,37 | 98,29 | 304,3 |
| NH3 (г) | -46,19 | 16,64 | 192,5 |
| HNO3 (ж) | -173,0 | -79,91 | 156,16 |
| NH4C1 (к) | -315,39 | -343,64 | 94,56 |
| NH4OH (ж) | -366,69 | -263,8 | 179,9 |
| О2 (г) | 0 | 0 | 205,03 |
| РСl3 (г) | -277,0 | -286,27 | 311,7 |
| РСl5 (г) | -369,45 | -324,55 | 362,9 |
| PbO (к) | -217,86 | -188,49 | 67,4 |
| PbO2 (к) | -276,86 | -218,99 | 76,44 |
| S (ромб.) | 0 | 0 | 31,88 |
| SO2 (г) | -296,9 | -300,37 | 248,1 |
| SO3 (г) | -395,2 | -370,37 | 256,23 |
| H2S (г) | -20,15 | -33,02 | 205,64 |
| SrO (к) | -590,4 | -559,8 | 54,4 |
| SrCO3 (к) | -1221,3 | -1137,6 | 97,1 |
| Zn (к) | 0 | 0 | 41,59 |
| ZnО (к) | -349,0 | -318,19 | 43,5 |
| ZnS (к) | -201,0 | -198,32 | 57,7 |
Т а б л и ц я Д. 2.5








