Т е м а 23. Властивості конструкційних металів IB і IIB груп
23.1. Рекомендації до вивчення теоретичного матеріалу
Серед розглянутих металів до конструкційних можна віднести лише мідь, цинк і кадмій, хоча в електронній промисловості і техніці широко використовуються також срібло, золото (IB підгрупа) і ртуть (IIB підгрупа). Варто звернути увагу на розходження в електронній конфігурації металів підгрупи міді і підгрупи цинку. В атомі міді (3d104s1) d-підрівень вважається завершеним, але він нестабільний і може віддавати один чи декілька електронів:
 |
тобто для міді можливі позитивні ступені окислення +1, +2 і +3. Для атомів підгрупи цинку останній d-підрівень стабільний: електрони підрівня d10 не відриваються. Оскільки валентними електронами є зовнішні (s2), то ці елементи в сполуках завжди двовалентні :
 |
Електродні потенціали металів також різко відрізняються: для міді електродний потенціал дорівнює +0,34В, тобто мідь не розчиняється в розведених сірчаній, соляній, оцтовій кислотах, тоді як цинк і кадмій (Е0 рівні –0,76 і –0,40В відповідно) витісняють водень із зазначених кислот. У концентрованій сірчаній кислоті й в азотній кислоті будь-якої концентрації всі три метали (Cu, Zn, Cd) добре розчинні, але відновлюють Н2SO4 і HNO3 до різних сполук.
Слід зазначити ще деякі відмінності у властивостях Cu, Zn і Cd і їхніх сполук. Цинк легко розчинний у водних розчинах лугів, а мідь і кадмій з лугом не взаємодіють. Гідроксиди цинку і міді – амфотерні (гідроксид міді розчинний у концентрованих лугах з утворенням купратів), а гідроксид кадмію в лугах не розчиняється. З іншого боку, гідроксиди всіх трьох елементів добре розчинні у водному розчині NH3 з утворенням аміакатів однакового складу [Me(NH3)4]2+.
Для всіх розглянутих металів характерне утворення численних комплексних сполук з неорганічними й органічними лігандами.
23.2. Приклади розв ¢ язування типових задач
Задача 1. При прожарюванні 1,56 м суміші ZnCO3 і Zn утворилось 1,34 г Zn. Обчислити склад вихідної суміші (у відсотках і по масі).
Розв’язок. При прожарюванні зазначеної суміші відбувається реакція:
ZnCO3 ® Zn + СО2. По масі СО2 (mсуміші – m Zn) знаходимо масу ZnCO3: 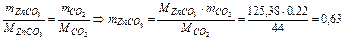 г.
г.
Тоді m ZnО = mсуміші - m 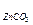 = 1,56 – 0,63 = 0,93 г.
= 1,56 – 0,63 = 0,93 г.
Знаходимо процентний склад суміші 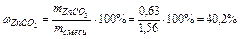 ;
;
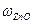 = 100% -40,2% = 59,8%.
= 100% -40,2% = 59,8%.
Задача 2. Знайти кількість теплоти, що поглинається при відновленні 1 кг оксиду Zn графітом.
Розв’язок. Реакція відновлення ZnО протікає відповідно рівнянню:
ZnО + С ® Zn + СО.
Використовуючи наслідок із закону Гесса, одержуємо: DН0298 = DН0СО - DН0ZnО = -110,5 + 350,6 = 240,1 кдж/моль. Знайдемо число молів ZnО, що містяться в 1кг: 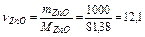 моль. Тоді DН0х.р. = 12,1×240,1 = 2705,2 кДж.
моль. Тоді DН0х.р. = 12,1×240,1 = 2705,2 кДж.
Задача 3. Які процеси відбуваються при електролізі розчинів купрум сульфату: а) анод мідний; б) анод платиновий (інертний)?
Розв’язок. У розчині даної солі містяться катіони Сu2+ і сульфат аніони SO42-
У випадку а) на катоді: К (-) Cu2+ + 2e ® Cu0 (відбувається відновлення міді, оскільки Е 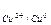 > E
> E 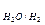 ),
),
а на аноді: А(+) Cu0 –2е ® Cu2+ (відбувається окиснення матеріалу анода, оскільки Е 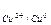 найменший).
найменший).
У випадку б) на катоді: К (-) Cu2+ + 2e ® Cu0 (відбувається відновлення міді, оскільки Е 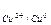 > E
> E 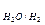 ),
),
а на інертному аноді: А(+) 2Н2О – 4е ® О2 + 4Н+ (відбувається окиснення води, тому що E 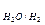 < E
< E 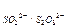 ).
).
22.3. Задачі для самостійного рішення 995, 984, 1025
23.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: розчини розведених і концентрованих кислот: соляної, сірчаної, азотної, оцтової; розчини CuCl2, AgNO3, суха сіль CuCl2, розчин аміаку, 2% розчин глюкози, спирт, ацетон, гліцерин, розчини моноетаноламіну, глікоколу.








