Дослід 4. Гідроліз солей Pb2+ і Sn2+
У дві пробірки наливають по 1 мл Н2O і додають небагато кристалічних SnCl2 у першу і PbCl2 – у другу. Реакційну суміш розмішують скляною паличкою й опускають у розчин папірець універсального індикатору. Відзначають рН розчинів. У першу пробірку додають ще 5-6 крапель води, відзначають утворення осаду гидроксохлориду олова (2+) SnOHCl. Другу пробірку нагрівають і додають у неї такий же розчин Na2CO3. Спостерігають випадання осаду PbCO3 . Pb(OH)2.
У висновках укажіть:
- Чому солі Sn2+ і Pb2+ підлягають гідролізу ?
- Додаванням якого реактиву можна зменшити гідроліз цих солей ?
Дослід 5. Синтез PbО2 (з елементами НДРС)
3 г плюмбум ацетату розчиняють у 20 мл 2н. оцтової кислоти. Взважують на вагах 2,5 г хлорного вапна і готують з нього насичений розчин: Для цього наважку CaOCl2 ретельно розтирають у ступці з 5 мл води, додають ще 10 мл води, розмішують і фільтрують через гладкий фільтр у хімічну склянку. Розчин ацетату свинцю нагрівають до 500С и при помішуванні доливають до розчину CaOCl2. Реакція протікає за рівнянням: 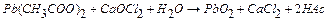 .
.
Після цього реакційну суміш кип'ятять 10-15 хвилин до випадання осаду. Після охолодження осад PbО2 фільтрують і промивають 2-3 рази водою на лійці Бюхнера. Потім осад разом з фільтром сушать у сушильній шафі при 1000С. Отриманий PbО2 зважують, розраховують вихід (%) по Pb(Ac)2.
Дослід 6. Електролітичне лудіння (з елементами НДРС)
Збирають установку, як зазначено на мал.4. У електролізер наливають розчин такого складу: 7 мл концентрованої HCl, 18 г SnCl2×2Н2О крист., 8 г NH4Cl, 1 л Н2О. Мідні електроди зачищають наждаковим папером, промивають водою і протирають фільтрувальним папером і зважують, не торкаючись пальцями поверхні. Електроди закріплюють у кришці електролізера клемами на невеликій відстані друг від друга і на 2/3 занурюють у розчин. Включають струм і за допомогою реостата регулюють його: I=0,2-0,25А; U=2,2B. Електроліз проводять, приблизно, 1 – 1,5 години. Потім, відключивши ланцюг, виймають катод з розчину, промивають водою, висушують, вимірюють площу лудженої поверхні і знову зважують. Знаючи силу струму, час електролізу, масу катода до і після виділення на ньому олова, розраховують товщину покриття (густина олова 5,85 г/см3). Визначають вихід металу по струму.
22.5. Список рекомендованої літератури
1. Фролов В.В. Химия. – М.: Высш. шк., 1986. – С. 421 - 423.
2. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С. 505 – 511; 2004. – С.420-426.
3. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. - С. 238.
4. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С. 421 – 430; 2001. – С.455-466.








