Дослід 7. Відновні властивості сполук ванадію (+2)
У дві пробірки наливають відповідно розчини KMnO4 і K2Cr2O7, підкислюють сульфатною кислотою і додають 3 – 5 крапель розчину VSO4 , отриманого у досліді 3. Спостерігають зміну забарвлення розчинів, записують рівняння реакцій.
21.5. Список рекомендованої літератури
1. Ахметов Н .С. Общая и неорганическая химия . –М.: Высш. шк..,2001. с 588 – 597
2. Кириченко В. І. Загальна хімія. – К.: Вища шк.,2005.-с. 439 – 449
3. Слободяник М. С., Улько Н. В., Бойко К. М., Самойленко В. М. Загальна та неорганічна хімія : Практикум. – К.: Либідь, 2004. – с. 208 – 215
4. Михайленко Я. И. Курс общей и неорганической химии. – М.: Высш. шк., 1966.- с. 303 – 317
Глинка Н. Л. Общая химия – Л.:Химия, 1988
Т е м а 22. Властивості р-металів IVВ групи – Sn, Pb
22.1. Рекомендації до вивчення теоретичного матеріалу
Станум і плюмбум відносять до сімейства р-елементів, загальна електронна формула: ns2np2, де n – номер періоду. Отже, для цих металів: Sn –5s25p2, для Pb –6s26p2. Практично для всіх s, p -елементів можливі ступені окиснення можуть бути визначені на підставі розподілу валентних електронів по квантових комірках у нормальному і збудженому стані. Для елементів підгрупи Ge:
у нормальному стані в збудженому стані
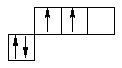 | 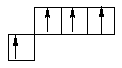 |
2 валентних електрони 4 валентних електрони
Таким чином, станум і плюмбум у сполуках можуть виявляти ступені окиснення 0;+2; +4.
При визначенні кислотно-основних властивостей оксидів і гідроксидів станума і плюмбума в ступенях окиснення +2 і +4 необхідно пам'ятати, що вони є проміжними металами V і VI періодів, отже, їхні оксиди і гідроксиди в цих ступенях окиснення амфотерні. Причому:
ослаблення кислотних властивостей
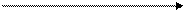 SnO PbO SnO2 PbO2
SnO PbO SnO2 PbO2
Sn(OH)2 Pb(OH)2 H2SnO3 H2PbO3
 посилення основних властивостей
посилення основних властивостей
Внаслідок амфотерності гідроксидів Sn(OH)2 і Pb(OH)2 метали олово і свинець легко розчиняються у водних розчинах лугів з утворенням водню і комплексної солі: 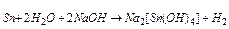 . Взаємодія цих металів з розведеними кислотами супроводжується окисненням станума і плюмбума до ступеня окиснення +2 і утворенням відповідних солей. Реакції протікають при нагріванні. Усі ці реакції гетерогенні, тому неодмінною умовою їхнього протікання є розчинність солей, що утворюються. З трьох солей PbCl2, PbSO4, Pb(NO3)2 розчинний тільки нітрат, тому свинець краще розчиняється в HNO3:
. Взаємодія цих металів з розведеними кислотами супроводжується окисненням станума і плюмбума до ступеня окиснення +2 і утворенням відповідних солей. Реакції протікають при нагріванні. Усі ці реакції гетерогенні, тому неодмінною умовою їхнього протікання є розчинність солей, що утворюються. З трьох солей PbCl2, PbSO4, Pb(NO3)2 розчинний тільки нітрат, тому свинець краще розчиняється в HNO3:
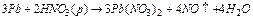

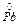 -2e ® Pb2+ 3
-2e ® Pb2+ 3
NO3- +4H+ +3e ® 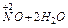 2
2
При взаємодії з концентрованими кислотами свинець у всіх випадках окиснюється до Pb (2+), і утворює з концентрованою H2SO4 кислу сіль – Pb(HSO4)2. C концентрованими сірчаною й азотною кислотами олово окиснюється до ступеня окиснення +4. Причому, при взаємодії з концентрованою азотною кислотою утворюється не сіль, а b-олов'яна кислота: 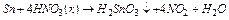 . Ця кислота не розчиняється ні в кислотах, ні в лугах.
. Ця кислота не розчиняється ні в кислотах, ні в лугах.
Окисно-відновні властивості сполук Sn і Pb обумовлені різною стійкістю їхніх сполук у різних ступенях окиснення. У ступені окиснення +4 вони можуть бути тільки окисниками (оскільки ступінь окиснення +4 максимальна). Причому ця властивість яскравіше виражена в сполук Pb+4, тому що для плюмбуму більш стійкими є сполуки в ступені окиснення +2. У ступені окиснення +2 сполуки цих елементів виявляють як окисні, так і відновні властивості, але, з огляду на велику стійкість сполук Sn (4+), більш характерний перехід Sn2+ - 2e® Sn+4, тобто прояв Sn (2+) відновних властивостей.
Завдяки наявності вакантних d-орбіталей, ці метали утворюють численні тетраедричні й октаедричні комплекси. Наприклад, гідроксокомплекси: Na2[Sn(OH)4], Na2[Sn(OH)6], K4[Pb(OH)6].
22.2. Приклади розв ¢ язування типових задач
Задача 1. Розрахуйте, чи вистачить 20г олова, що містить 5% домішок, для одержання 2,24 л Н2 (н.у.) у реакції олова з HCl?
Розв’язок. Розрахуємо, скільки в зразку олова діючої речовини: 20-20∙ 0,05 =19 г. Використовуючи закон еквівалентів, обчислимо, скільки необхідно металу для одержання зазначеного об¢єму Н2: 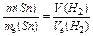 , тоді
, тоді 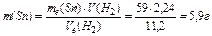 .
.
Для одержання 2,24 л Н2 необхідно 5,9 г (Sn), що на 13,1 г менше, ніж дано за умовою. Відповідь: вистачить.
Задача 2. Визначте тепловий ефект реакції, використовуючи значення стандартних ентальпій утворення: 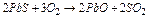
Розв’язок. По наслідку з закону Гесса: 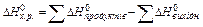
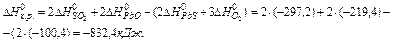
Задача 3. Користуючись таблицею стандартних окисно-відновних потенціалів, визначте продукти і можливість протікання реакцій за стандартних умов:
а) 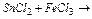 ; б)
; б) 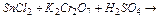 .
.
Розв’язок. а) Через більшу стійкість Sn (4+), у даній реакції Sn2+ є відновником: Sn2+-2  ® Sn4+, E0=-0,15B,
® Sn4+, E0=-0,15B,
отже, Fe3+ - окисник: Fe3++ 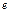 ® Fe2+, E0=0,771B. Е.Р.С.=Е0ок.– Е0відн.=0,771+0,15 = 0,921В. Реакція йде самовільно у прямому напрямку:
® Fe2+, E0=0,771B. Е.Р.С.=Е0ок.– Е0відн.=0,771+0,15 = 0,921В. Реакція йде самовільно у прямому напрямку:

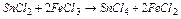
Sn2+ - 2 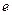 ® Sn4+ 1
® Sn4+ 1
Fe3+ + е ® Fe2 2
Sn2+ +2Fe3+ = Sn4+ + 2Fe2+
б) Sn2+ - відновник: 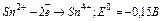 ;
;
K2Cr2O7 - окисник: 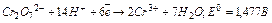 .
.
Е.Р.С. = 1,477+0,15 =1,627В. Реакція йде самовільно. Отже, рівняння реакції виглядає так:
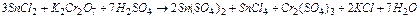
 Cr2O72- + 14H+ +6
Cr2O72- + 14H+ +6 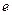 ® 2Cr3+ + 7H2O 1
® 2Cr3+ + 7H2O 1
Sn2+ -2е ® Sn4+ 3

3Sn2+ + Cr2O72- + 14H+ = 3Sn4+ + 2Cr3+ + 7H2O
22.3. Задачі для самостійного рішення: 1071, 1072, 1077
2.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: розчини розведених і концентрованих кислот HCl, H2SO4, HNO3, розчини NaOH, SnCl2, KMnО4, K2Cr2O7, Bi(NO3)3, Pb(Ac)2, CaOCl2, KI, Na2CO3, кристалічні NH4Cl, PbО2, SnCl2, PbCl2.








