21. Властивості металів VB групи (підгрупи ванадію)
21.1 Рекомендації до вивчення теоретичного матеріалу






 Загальна формула металів VB групи (N, Nb, Ta) – (n-1)
Загальна формула металів VB групи (N, Nb, Ta) – (n-1) 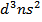 , але у елемента 41Nb спостерігається «провал» електрона, тобто його електронна формула
, але у елемента 41Nb спостерігається «провал» електрона, тобто його електронна формула 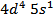 .
.
 | |||||
 | |||||
 | |||||

 23V , 73Ta 41Nb
23V , 73Ta 41Nb
Максимальний позитивний ступінь окиснення дорівнює 3+2 або 4+1=5;
Найнижчий ступінь окиснення +2. Але відомі чисельні сполуки металів зі ступенями окиснення +3 і +4. Найбільш характерні оксиди:
EO, E2O3– основні оксиди (E = V, Nb, Ta)
EO2– амфотерні оксиди
E2O5– кислотні оксиди ( ангідриди кислот)
Для ванадія відомі численні різнобарвні оксиди нестехіометрічного складу: сірий VO (VO0.9-1.2) , чорний V2O3 (VO1.6-1.8) , синій VO2 (VO1.8-2.17) , червоний V2O5. Стандартні електродні потенціали металів VB групи (Me0 – zē → Mez+) (E,B):
Me = V (-1,19; z = 2); Nb (-1,10; z = 3); Ta (-1,13; z = 5).
За звичайних температур у компактному вигляді ванадій, ніобій і тантал інертні: лише ванадій повільно розчиняється у плавиковій кислоті (HF) і концентрованій 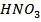 , утворюючи сполуки ванадію (+5): 3V+5HNO3 → 3HNO3+5NO+H2O.
, утворюючи сполуки ванадію (+5): 3V+5HNO3 → 3HNO3+5NO+H2O.
Ніобій і тантал розчиняються у суміші HNO3 і HCl («царська водка»), або, краще у суміші HNO3 і HF:
3Nb + 5HNO3 + 21HF=3H2[NbF7] + 5NO + 10H2O
У стані порошків ванадій, ніобій і тантал реагують при високих температурах з більшістю оксидів (О2, S, Se,галогени) з утворенням сполук Ме (+5). Порошки V, Nb i Ta адсорбують водень, утворюючи тверді розчини змішаного складу.
За звичайних умов найбільш характерними є ступені окиснення +4 і +5, наприклад, МеHal5, MeO2Hal, MeOHal3 , MeOHal2 (Hal – галоген).У водних розчинах вказані сполуки гідролізуються. Слід уважно розглянути по підручнику властивості сполук ванадію +2, +3, +4 і +5, звернувши особливу увагу на схильність V (+4) і V(+5) до реакції полімеризації з утворенням ізо- і гетерополіванадатів: V2О74- , V6О174- , НV6О173- , V10О286- і інші. Ступінь полімеризації залежить від рН і концентрації іонів ванадію у розчині. У нейтральному і лужному середовищах ванадій (+5) існує у вигляді мономерного ванадат-іона VО3-.
Слід звернути увагу на виробництво металів VВ групи і застосування їх у техніці і промисловості (виробництво сплавів, електронна промисловість, виробництво скла і кераміки, тощо).
21.2. Приклади розв’язування типових задач
Задача1. Яка з двох солей: VCl2 чи VCl5 підлягають більшому гідролізу і чому?
Розв’язок. Дихлород ванадія VCl2  має іонний тип зв’язку, тому такі солі гідролізуються переважно по першому ступеню і утворюють прозорі розчини:
має іонний тип зв’язку, тому такі солі гідролізуються переважно по першому ступеню і утворюють прозорі розчини:
VCl2 + HOH ↔ V(OH)Cl + HCl
Пентахлорид VCl5 - молекула з ковалентним типом зв’язку. Будучи кислотними сполуками, солі такого типу підлягають значно більшому гідролізу. Отже, VCl5 при взаємодії з водою сильно гідролізується з утворенням амфорного осаду гідратованого оксиду:
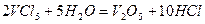
Задача 2. Як взаємодіє ванадій сульфат з розчинами 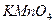 та
та 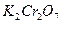 ? Складіть рівняння електронно- іонного балансу.
? Складіть рівняння електронно- іонного балансу.
Розв’ язок. Ванадій сульфат 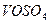 з сильними окисниками виявляє відновні властивості:
з сильними окисниками виявляє відновні властивості:
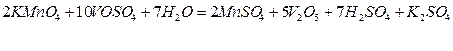
а) 

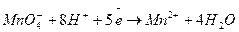 2
2
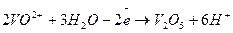 5
5
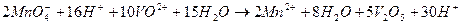
Або після скорочення 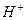 і
і 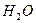 :
:
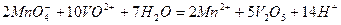
б) 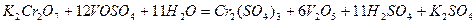
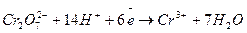
 1
1
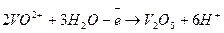 6
6
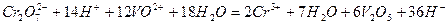
Після скорочення 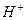 і
і 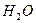 сумарне іонне рівняння має вигляд:
сумарне іонне рівняння має вигляд:
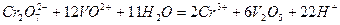
Таким чином, сильні окисники окиснюють іон ванадію до 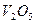 (у гідратованій формі).
(у гідратованій формі).
21.3. Задачи для самостійного розв’язування : №1081, 1082
21.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: сухі реактиви - NH4VO3, V2O5, розчини HCl (10%), KOH (10%), H2SO4 розб. , KІ, KІO3, KMnO4, K2Cr2O7
Дослід 1. Одержання ванадій ( V ) оксиду
У фарфоровий тигель поміщають невелику кількість кристалічного амоній метаванадату NH4VO3 і обережно нагрівають у полум’ї пальника до перетворення його у червоно – коричневий порошок V2O5. Записують рівняння реакції
Дослід 2. Визначення властивостей V 2 O 5
У три пробірки поміщають невелику кількість V2O5 і додають відповідно по 2-3 мл H2O, розбавленої хлоридної кислоти (~10%), 10%-ний розчин лугу, перемішують реакційну суміш. Нагрівають пробірки до кипіння, відмічають розчинність V2O5 у кожному випадку на холоді та при нагріванні.








