Дослід 5. Окисно-відновні властивості сполук Cr і Mn
а) відновні властивості солей хрому (3+)
До 1 мл солі хрому (3+) доливають надлишок КОН до розчинення випадаючого спочатку осаду й утворення K3[Cr(OH)6]. Потім додають декілька крапель 3% розчину Н2О2. Нагрівають суміш у склянці з гарячою водою до переходу зеленого кольору в жовтий, що вказує на утворення в розчині хромата калію K2CrО4.
б) окисні властивості хроматів
Розчин хромата калію наливають у 4 пробірки (по 1мл) підкислюють розчином 2н. H2SO4. У першу пробірку вносять по краплях розчин сульфіду натрію до зміни забарвлення суміші. Відзначають помутніння розчину. В другу пробірку додають йодид калію. Визначають за допомогою розчину крохмалю виділення вільного йоду. У третю додають розчин сульфату заліза (2+), а потім NH4SCN. Відзначають характерне забарвлення. У четверту – Na2SO3 до зміни кольору розчину. Записують рівняння чотирьох реакцій, підбираючи коефіцієнти методом напівреакцій.
У висновку вкажіть:
- До якого ступеня окиснення відновлюється хром (6+) ?
- Чому напівреакція відновлення в чотирьох розглянутих вище випадках однакова ?
в) окиснення солі марганцю (2+) пероксодисульфатом амонію
У пробірку до 1/3 об¢єму наливають воду, додають 3-4 кристалика (NH4)2S2O8 і 3-4 краплі розчину каталізатора AgNO3. Нагрівають суміш до кипіння і додають краплю розчину сульфату марганцю. Відзначають забарвлення розчину і записують рівняння реакції (утворюється марганцева кислота).
г) окисно-відновна подвійність MnО2
У пробірку поміщають 1 мікрошпатель оксиду марганцю (4+) і 2-3 краплі концентрованої соляної кислоти. По запаху і кольору визначають, який газ виділяється? Записують рівняння реакції. У тигель кладуть невеликий шматочок NaOH (пінцетом) і кристалічний нітрат калію. Тигель обережно нагрівають до розплавлення суміші і додають мінімальну кількість MnО2, продовжуючи нагрівання, поки маса не загустіє.
Записують рівняння реакцій, з урахуванням того, що MnО2 окиснюється до Na2MnО4.
У висновках укажіть: у якому випадку MnО2 -окисник, у якому – відновник і чому ?
Дослід 6. Одержання хромових покриттів (електролітичне хромування) (елементи НДРС)
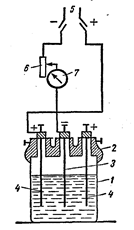 |
Установка для гальванічного покриття складається з хімічної склянки (1), ебонітової покришки з трьома клемами (2), сталевого катода (3), активного металевого анода (4), рубильника (5), реостата (6), амперметра (7).
Рис. 5. Схема установки для гальванічного покриття
Мідну пластинку ретельно полірують крейдою і промивають струменем води. Закріплюють її в кришці електролізера і приєднують до негативного полюса джерела постійного струму (катоду), а до іншої клеми (+) приєднують свинцеву пластинку – анод. Наливають електроліт: у 200 мл – 50г CrО3 і 10 крапель 96% H2SO4. Электролізер закривають, ставлять у гарячу воду (500С). По досягненню необхідної температури встановлюють реостат (мал. 4) на повний опір R, досягаючи сили струму I=5A. Через 5 хвилин знижують I до 2,5А. Робоча напруга складає 6-8 В. Електроліз проводять протягом 15-20 хвилин, після чого розмикають ланцюг і розглядають шар хрому, що утворився.
20.5. Список рекомендованої літератури
1. Фролов В.В. Химия. – М.: Высш. шк., 1986. – С. 340 - 360.
2. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С. 633 – 645; 2004. – С. 511-521.
3. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 238 – 241.
4. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С. 548 – 579; 2001. – С. 597-629.








