Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
20.1. Рекомендації до вивчення теоретичного матеріалу
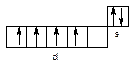 Елементи обох підгруп відносять до d – металів. Для хрому і молібдену, на відміну від вольфраму (5d46s2), характерне явище провалу електрона: ((n-1)d5ns1).
Елементи обох підгруп відносять до d – металів. Для хрому і молібдену, на відміну від вольфраму (5d46s2), характерне явище провалу електрона: ((n-1)d5ns1).
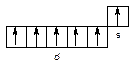 |
W Cr, Mo
Вищий ступінь окиснення цих елементів (+6) відповідає номеру групи і визначається сумою електронів, що знаходяться на s підурівні зовнішнього і d підурівні предостаннього електронного рівня. Для елементів підгрупи марганцю (Mn, Tc, Re) валентні електрони розподілені відповідно до формули ((n-1)d5ns2).
 |
Мn
Вищий ступінь окиснення +7 дорівнює номеру групи. Для елементів обох підгруп, як і для всіх d елементів, нижчий позитивний ступінь окиснення +2. Однак існує цілий ряд проміжних ступенів окиснення для елементів обох підгруп (див. рекомендовану літературу). З підвищенням ступеня окиснення підсилюються кислотні властивості оксидів і відповідних їм гідроксидів, а основні слабшають.
Найбільш характерні оксиди:
CrО Cr2O3 CrО3
MnО MnО2 MnО3 Mn2O7
основні амфотерні кислотні
кислотні властивості посилюються
 |
Щоб довести амфотерність оксиду або гідроксиду, необхідно показати прояв цією сполукою основних чи кислотних властивостей у реакціях взаємодії з кислотою і з основою.
З підвищенням ступеня окиснення елемента посилюються окисні властивості даної сполуки, а відновні слабшають, тобто :
Cr+2 ® Cr+3 ® Cr+6
Mn+2 ® Mn+4 ® Mn+7
 |
посилюються окисні властивості
 |
посилюються відновні властивості
Окисна здатність іонів у максимальному ступені окиснення в значній мірі залежить від середовища, у якій протікає окисно-відновна реакція, і найсильніше виявляється в кислому середовищі.
У розчині Cr+6 і Mn+7 існують у виді іонів CrО42- Cr2O72- (чи інших більш складних іонів) і MnО4- відповідно. Для елементів підгрупи хрому (Cr, Mo, W) характерне утворення складних ізополі- і гетерополіаніонів: [Cr3O10]2- - трихромат, [Cr4O13]2- - тетрахромат. Усі зазначені елементи – гарні комплексоутворювачі. Вони утворюють широкий спектр комплексних сполук, що відрізняються по геометричній будові, хімічному складу і ступеням окиснення центрального атома:
Mn-3: Na3[Mn(NO)3CO];
Cr-2: Na2[Cr(CO)5]; Mn-2: Na2[Mn(фталоціанін)];
Cr-1: Na2[Cr2(CO)10]; Mn-1:Na[Mn(CO)5];
Cr0: Cr(CO)6; Mn0: Mn2(CO)10;
Mn+1: Mn(CO)5Cl;
Cr+2: CrF2, CrCl2, [Cr(bipy)2]2+; Mn+2: K2[MnCl4], [Mn(H2O)6]Cl2;
Cr+3: [Cr(NH3)6]3+, Na[Cr(OH)4]; Mn+3: K2[MnCl5];
Cr+4: K2[CrF6]; Mn+4: K2[MnCl6];
Cr+5: K2[CrOCl5];
Cr+6: Na2CrO4, CrO2Cl2. Mn+6: K2MnO4;
Mn+7: KMnO4, MnO3F.
20.2. Приклади розв ¢ язування типових задач
Задача 1. Визначіть продукти реакції, підберіть коефіцієнти в рівнянні і визначте Е.Р.С. реакції 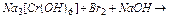
Розв’язок. У складі гексагідроксохроміту – Cr+3 у лужному середовищі буде виступати відновником, а бром – окисником, тоді, застосувавши іонно-електронний метод, слід записати:
 [Cr(OH)6 ]3-+ 2OH- - 3
[Cr(OH)6 ]3-+ 2OH- - 3 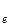 ® CrO42- + 4H2O 2 E0= -0,13 B
® CrO42- + 4H2O 2 E0= -0,13 B
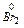 + 2
+ 2 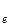 ® 2 Br- 3 E0= 1,065 B
® 2 Br- 3 E0= 1,065 B
 2 [Cr(OH)6]3- + 3Br2 + 4OH- = 2 Cr42- + 8H2O + 6 Br-
2 [Cr(OH)6]3- + 3Br2 + 4OH- = 2 Cr42- + 8H2O + 6 Br-
таким чином, у продуктах реакції: вода, бромід натрію, хромат натрію. Рівняння має молекулярний вид:
2 Na3[Cr(OH)6] + 3 Br2 + 4NaOH ® 2 Na2CrО4 + 6 NaBr + 8 H2O
ЕРС = Еок. – Е відн. = 1,065 – (-0,13) = 1,195 В.
Задача 2. Допишіть рівняння реакцій, підберіть коефіцієнти і розрахуйте масу 10% розчину HCl, необхідну для виділення 44,8 л (н.у.) Cl2 у реакціях, зазначених нижче:
а) KMnО4 + HCl ® Cl2 ....
б) K2Cr2O7 + HCl ® Cl2 ...
Розв’язок. Підберемо коефіцієнти в цих рівняннях, використовуючи іонно-електронний метод:
а) 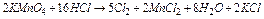 ;
;
 MnO4- + 8H+ + 5
MnO4- + 8H+ + 5 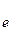 ® Mn2+ + 4H2O 2
® Mn2+ + 4H2O 2
 2Cl- - 2
2Cl- - 2 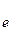 ®
® 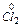 5
5
2MnO4- + 16H+ + 10 Cl- = 2Mn2+ + 8H2O + 5Cl2
б) 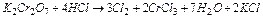

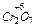 2- +14H+ + 6
2- +14H+ + 6 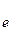 ® 2Cr3+ + 7H2O
® 2Cr3+ + 7H2O
 2Cl- -2
2Cl- -2 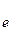 ®
® 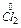 3
3
Cr2O72- + 14 H+ + 6Cl- = 2Cr3+ +7H2O + 3Cl2
З формули 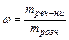 Þ
Þ 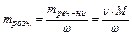 .
.
У випадку а) 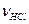 знаходимо по рівнянню: 6,4 моль, відкіля
знаходимо по рівнянню: 6,4 моль, відкіля 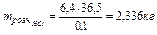 .
.
У випадку б) 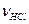 знаходимо по рівнянню: 9,3 моль, відкіля
знаходимо по рівнянню: 9,3 моль, відкіля 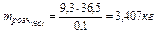 .
.
Задача3. Здійсніть перетворення:
Cr2O3 ® K2CrО4 ® K2Cr2O7 ® Cr2(SO4)3®K3[Cr(OH)6]
Розвязок.
1) 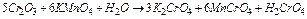
 Сr 2 O3 + 5H2O - 6
Сr 2 O3 + 5H2O - 6 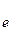 ® 2Cr42- + 10H+ 5
® 2Cr42- + 10H+ 5
MnO4- + 8H+ + 5 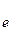 ® Mn2+ + 4H2O 6
® Mn2+ + 4H2O 6

5Cr2O3 + H2O+6MnO- = 10CrO4- + 2H+ +6Mn2+
2) 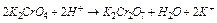
3) 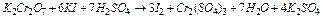
 Cr2O72- +14H+ +6
Cr2O72- +14H+ +6 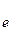 ® 2Cr3+ +7H2O
® 2Cr3+ +7H2O
2I- - 2 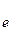 ®
® 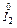 3
3
 |
Cr2O72- + 14H++2I- = 2Cr3+ + 7H2O + 7H2O + 3I2
4) 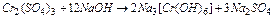
2Cr3+ + 12OH- ® 2[Cr(OH)6]3-
20.3. Задачі для самостійного рішення: 1084, 1096, 1097
20.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: Розчини концентрованих і розведених кислот: HCl, H2SO4, HNO3, розчини NaOH, бромної води, 3% розчин H2O2, розчини K2Cr2O7, Na2S, NH4SCN, Na2SO3, AgNO3, оксиди MnО2, Cr2O3, сухі солі Mn2O4, (NH4)2S2O8.








