У висновку вкажіть: чому відбулося знебарвлення розчину в обох пробірках ?
б) невелику кількість безводних солей NiCl2 і CoCl2 розчиняють у воді. Відзначають колір вихідних солей і розчину аквакомплексів. Записують рівняння реакції утворення аквакомплексів і їх первинної дисоціації.
в) до 1 мл насиченого розчину солі кобальту (2+) додають 2 мл насиченого розчину NH4SCN. Відзначають синє забарвленняння отриманого розчину. Складають рівняння реакції утворення комплексного кобальтата, з урахуванням того, що к.ч. Со2+ = 4.
Розчин розбавляють водою, перемішують, додавши трохи крапель суміші спирту з ефіром. Спостерігають зміну забарвлення. Потім у ту ж пробірку доливають дистильовану воду до забарвлення розчину в рожевий колір. Записують рівняння реакції одержання аквакомплекса Со2+ (к.ч. = 6), рівняння дисоціації комплексного іона, приводять вираз Кнест . зі значенням, знайденим по таблиці.
У висновку вкажіть: яка роль води і спирту в зміщенні рівноваги дисоціації комплексного іона.
г) у пробірку доливають 1 мл солі нікелю (2+) і ½ мл аміачного розчину диметилгліоксима. Відзначають колір осаду, що випав.
Записують рівняння реакції утворення нерозчинного комплексного хелата диметилгліоксимата нікелю:
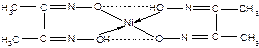 |
(пунктиром позначений водневий зв'язок). Реакцію використовують для виявлення іонів нікелю в розчині.
У висновку вкажіть:
- Який тип зв'язку Ni – Lig?
- Який механізм утворення зв'язку – і ® ?
Дослід 5. Окисно-відновні властивості сполук заліза
а) відновні властивості Fe (2+)
До 1 мл солі Fe (2+) доливають ½ мл 2 н. розчину Н2SO4 і ½ мл 3% розчину Н2О2 пероксиду водню. Потім додають кілька крапель NH4SCN. Відзначають появу червоного кольору розчину.
Записують рівняння реакції. Розраховують Е.Р.С. даного процесу.
У висновку вкажіть:
- Чому Fe (2+) виявляє властивості відновника?
- Навіщо додавали NH4SCN ?
б) окисні властивості Fe (3+)
У пробірці змішують 1 мл солі Fe (3+) і ½ мл розчину КІ. Додають 2 - 3 краплі розчину крохмалю. По характерному забарвленню виявляють елементарний I2.
Записують рівняння реакції. Розраховують Е.Р.С.
У висновку вкажіть: чи може Fe (3+) виявляти і відновні властивості?
Дослід 6. Хімічне нікелювання (Елементи НДРС)
Хімічне нікелювання – окисно-відновна взаємодія іонів нікелю (окисника) з відновником, наприклад, гіпофосфітом натрію, у результаті якого на поверхні металу утворюється шар нікелю:
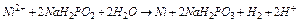 .
.
У хімічну склянку (100 мл) наливають 75 мл спеціального розчину: (30 г NiCl2, 10 г Na2PO2 + 10 г CH3COOH у 1 літрі розчину). Нагрівають його на слабкому вогні до 950С (контроль термометром). Очищають від іржі сталеву пластинку наждаковим папером, потім крейдою, промивають її в струмені води й акуратно підвішують над склянкою, не доторкуючись поверхні пластинки. Нікелювання здійснюється протягом ½ години. Потім пластинку виймають з розчину, промивають у струмені води, сушать між смужками фільтрувального папера. Аналізують візуально покриття пластинки нікелем.
19.5. Список рекомендованої літератури
1. Фролов В.В. Химия. – М.: Высш. шк., 1986. – С. 361 - 376.
2. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С. 667 – 676; 2004. – С. 522-530.
3. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 242 - 244.
4. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.- С. 580 – 617; 2001. – С. 630-675.








