Т е м а 19. Властивості заліза, кобальту, нікелю
19.1. Рекомендації до вивчення теоретичного матеріалу
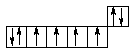 Зазначені елементи відносяться до I тріади восьмої групи і різко відрізняються за властивостями від елементів II і III тріади. Виходячи з електронних формул і розподілу електронів по квантових комірках:
Зазначені елементи відносяться до I тріади восьмої групи і різко відрізняються за властивостями від елементів II і III тріади. Виходячи з електронних формул і розподілу електронів по квантових комірках:
26Fe ... 3d64s2
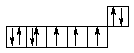
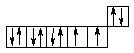 27Co ...3d74s2
27Co ...3d74s2
28Ni ...3d84s2
можна прогнозувати наступні ступені окиснення: для Fe від 0 до +6 (недавно отримана сполука 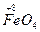 ), для Со від 0 до +5 (комплексні сполуки
), для Со від 0 до +5 (комплексні сполуки 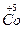 нечисленні і малодосліджені), для Ni - від 0 до +4. Таким чином, у ряді: Fe-Co-Ni, чітко просліджується тенденція до зниження стійкості вищих станів окиснення. Програмою курсу хімії для нехімічних спеціальностей передбачено вивчення властивостей металів і їх сполук, у яких іони металів мають найбільш типові ступені окиснення: Fe +2, +3, +6; Co +2, +3 і Ni +2, +3.
нечисленні і малодосліджені), для Ni - від 0 до +4. Таким чином, у ряді: Fe-Co-Ni, чітко просліджується тенденція до зниження стійкості вищих станів окиснення. Програмою курсу хімії для нехімічних спеціальностей передбачено вивчення властивостей металів і їх сполук, у яких іони металів мають найбільш типові ступені окиснення: Fe +2, +3, +6; Co +2, +3 і Ni +2, +3.
Стандартні електродні потенціали заліза, кобальту і нікелю (-0,44; -0,27 і –0,25В відповідно) свідчать про те, що ці метали відносяться до средньоактивних.
Вирішуючи питання про відношення Fe, Co, Ni до водних розчинів лугів, кислот, необхідно пам'ятати, що дуже концентровані сірчана й азотна кислоти пасивують залізо і нікель. У розведених неокислюючих кислотах (Н2SO4, HCl) ці метали розчиняються з утворенням сполук Fe(2+), Co(2+), Ni(2+). Необхідно мати на увазі, що якщо в ступені окиснення +2 для всіх цих елементів відомі оксиди, гідроксиди і солі (прості і комплексні), то в ступені окиснення +3 Co і Ni не утворюють простих солей. Тому в реакції: Ni2O3 + HCl ®… варто очікувати утворення не NiCl3, а NiCl2 (окисно-відновна реакція):
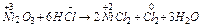
 |
2Ni3+ +  2e ® 2Ni2+ окисник
2e ® 2Ni2+ окисник
2Cl- - 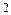 e ®
e ® 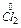 відновник
відновник
Типові метали в ступенях окиснення +2, +3, +6 дають оксиди, для яких характерні основні, амфотерні і кислотні властивості відповідно. Fe, Co, Ni у ступенях окиснення +2, +3 дають численні стійкі комплексні сполуки з різними лігандами (нейтральними, органічними, неорганічними молекулами, аніонами). Координаційне число заліза у більшості комплексних сполук зазвичай дорівнює шести, а для кобальту і нікелю в сполуках катіонного типу – 6, аніонного типу – 4. Треба також зазначити, що отримані комплексні сполуки, у яких Fe, Co і Ni виявляють формальний негативний ступінь окиснення, наприклад: 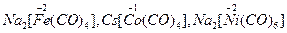 .
.
19.2. Приклади розв ¢ язування типових задач
Задача 1. Запропонуйте способи одержання Fe(OH)3 і Co(OH)3.
Розв’язок. Для одержання Fe(OH)3 можна використовувати загальний метод одержання нерозчинних у воді основ, тобто до розчину солі Fe (3+) потрібно додати розчин лугу:
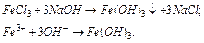
Гідроксид кобальту (3+) не можна одержати таким способом, тому що прості солі кобальту (3+) невідомі. Єдиний шлях – окиснення гідроксида кобальту (2+):
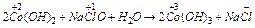 .
.
 |
Co2+ - e ® Co3+ 2 відновник
Cl+1 + 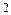 e ® Cl- 1 окисник
e ® Cl- 1 окисник
Задача 2. Які солі можна одержати при сплавленні Fe, Fe2O3, FeО3 з лугами?
Розв’язок. Оскільки Fe – основний , Fe2O3 – амфотерний, FeО3 – кислотний оксид, то з лугами взаємодіє два останніх з утворенням феррита і феррата відповідно:
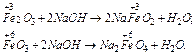
Задача 3. Складіть формули комплексних іонів, які можна одержати з наступних часток: Fe3+, Co2+, CN-, NH3.
Розв’язок. З приведених часток комплексоутворювачами можуть виступати: Fe3+, Co2+, лігандами – CN-, NH3. З урахуванням цього можна скласти, наприклад, формули наступних комплексних іонів: [Fe(CN)6]3-, [Fe(NH3)6]2+, [Co(CN)4]2-, [Co(NH3)6]2+.
19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
19.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: сухі солі (оксалати кобальту і нікелю), розчини H3PO4, НF розчини розведених і концентрованих HCl, HNO3, H2SO4, розчин NaOH, розчини солей Co(2+), Ni(2+), Fe(2+), Fe(3+), розчини H2O2, бромної води, аміаку (25%), KI, NH4SCN.








