Дослід 4. Одержання і ви значення властивостей гідроксидів Be2+, Mg2+, Al3+
У 4 пробірки доливають по 2-3 мл розчинів солей відповідних металів (Be2+, Mg2+, Al3+, Ti2+). Потім додають у кожну пробірку по краплях луг – 2н. розчин NaOH до випадіння осадів гідроксидів. Осади, що випали, поділяють на 2 частині. До першого додають по краплях 2 н. розчин HCl до другого – розчин NaOH. Відзначають розчинення осадів у випадку гідроксидів Ве (2+) і Al (3+). У випадку Ті (4+) випадає гідроксид оксотитану TiО(OH)2, що розчиняється в кислоті при нагріванні і не розчиняється у водних розчинах лугів. Записують рівняння відповідних реакцій.
У висновку вкажіть: кислотні, основні чи амфотерні властивості виявляють досліджувані гідроксиди?
Дослід 5. Відбудовні властивості Mg і Al
У дві пробірки з розчинами K2Cr2O7 і КМnО4 додають по 1 мл H2SO4 і вносять небагато стружки Mg. Спостерігають зміну первісного забарвлення розчинів. Складають рівняння реакції, використовуючи електронно-іонний метод, з урахуванням того, що 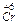 відновлюється до
відновлюється до 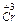 , а
, а 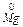 окислюється до
окислюється до 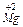 . Виконують аналогічні досліди з порошком алюмінію. Складають рівняння реакцій.
. Виконують аналогічні досліди з порошком алюмінію. Складають рівняння реакцій.
Дослід 6. Окисно-відновні властивості сполук титана
а) наливають у пробірку 3-5 мл 2 М розчину сірчаної кислоти і всипають мікрошпателем небагато порошку титану, підігрівають до появи фіолетового забарвлення розчину.
Отриманий розчин Ti2(SO4)3 поділяють на дві частини. У першу частину додають по краплях розчин FeCl3, а в другу – розчин КМnО4 до повного зникнення забарвлення. Записують рівняння реакцій відновлення Fe3+ до Fe2+ і MnО4- до Mn2+ сульфатом титана (3+);
б) у пробірку з розчином сульфату оксотитана 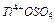 вносять
вносять
1-2 мл 2М розчину H2SO4 і гранулу Zn. Пробірку нагрівають до забарвлення розчину у фіолетовий колір, характерний для іона Ti(3+). Записують рівняння реакції, використовуючи електронно-іонний метод.
Переносять 2-3 краплі фіолетового розчину Ti(3+) у чисту пробірку і струшують 2-3 хвилини. Відзначають зміну кольору розчину. Записують рівняння реакції окиснння Ti(3+) до солі титана (4+) киснем повітря при участі в реакції молекул води.








