Т е м а 18. Властивості легких конструкційних металів ( Be , Mg , Al , Ti )
18.1. Рекомендації до вивчення теоретичного матеріалу
З усього різноманіття металів до легких конструкційних металів можуть бути віднесені лише чотири метали – Be, Mg, Al і Ti, причому як конструкційний матеріал магній використовується винятково у виді сплавів. Це зв'язано з дуже високою реакційною здатністю магнію ( 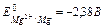 ). Оксидна плівка магнію, на відміну від оксидних плівок берилію, алюмінію і титану, не має захисних властивостей (знайдіть по підручнику В.В.Фролова значення фактора Піллінга-Бедвордса a для зазначених металів і порівняйте їх).
). Оксидна плівка магнію, на відміну від оксидних плівок берилію, алюмінію і титану, не має захисних властивостей (знайдіть по підручнику В.В.Фролова значення фактора Піллінга-Бедвордса a для зазначених металів і порівняйте їх).
Берилій і його сполуки дуже отруйні, що необхідно враховувати при роботі з ними; при попаданні на шкіру рук сполук Be2+ необхідно змити їх водою і ретельно вимити руки милом.
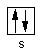 Берилій і магній – s-елементи (ns2)
Берилій і магній – s-елементи (ns2)
Характерні ступені окиснення 0 і +2. Варто звернути увагу на розходження у властивостях берилію і магнію. Берилій, на відміну від магнію, розчинний у розчинах лугів, оскільки гидроксид берилію амфотерний (розгляніть механізм розчинення берилію у водних розчинах лугів). Оксидна плівка пасивує берилій, тому концентровану сірчану кислоту берилій відновлює до SO2, а магній – до H2S. Для магнію нехарактерно утворення комплексних сполук; для берилія відомі гідроксокомплекси, галогенідні і деякі інші комплекси.
Алюміній відноситься до р-елементів (ns2np1):
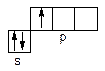 |
а титан – до d-елементів ((n-1)d2ns2):
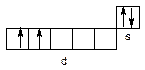 |
Для алюмінію характерний позитивний ступінь окиснення +3; титан у сполуках виявляє ступені окиснення +2, +3 і +4. Зверніть увагу на зміну кислотно-основних властивостей оксидів і гідроксидів титана в різному ступені окиснення: TiО – типовий основний оксид, тоді як TiО2 має амфотерні властивості. Оксидні плівки на поверхні алюмінію і титану пасивують їх, що дозволяє використовувати титан і алюміній у промисловості і техніці як у чистому виді, так і у виді сплавів.
18.2. Приклади розв ¢ язування типових задач
Задача 1. При розчиненні 0,39 г сплаву магнію з алюмінієм у 50 г 5% розчину НСl виділилося 448 мл газу (обмірюваного при нормальних умовах). Обчислити склад сплаву у відсотках і по масі.
Розв’язок. Магній і алюміній реагують із НСl, витісняючи з кислоти гідроген:
Mg + 2HCl ® MgCl2 + H2 Al + 3HCl ® AlCl3 + 1,5 H2.
Нехай у 0,39 г сплаву міститься х моль Mg і у моль Al, тоді mсплаву = Ммg×x + MAl ×y = 24x + 27y = 0,39.
Відповідно до рівнянь реакцій на 1 моль Mg виділяється 1 моль Н2, а на х моль – х моль Н2. На 1 моль Al виділяється 1,5 моль Н2, а на у моль – 1,5 у моль Н2. Тоді справедливо записати: 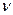 Н
Н 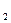 = х + 1,5у. Число моль водню, що виділилився за умовою задачі, знаходимо по формулі:
= х + 1,5у. Число моль водню, що виділилився за умовою задачі, знаходимо по формулі:
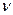 Н
Н 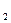 =
= 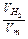 =
= 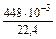 = 0,02 моль.
= 0,02 моль.
Вирішуючи систему алгебраїчних рівнянь:

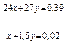 } ,
} ,
одержуємо х = 0,005 моль (Mg); у = 0,01 моль (Al). Знаходимо маси магнію й алюмінію в 0,39 м сплаву:
mMg = 24×0,005 = 0,12 г; mAl = 27×0,01 = 0,27 г.
Знаходимо масові частки компонентів сплаву:
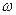 % (Mg) =
% (Mg) = 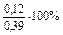 = 30,8%;
= 30,8%;  % (Al) =
% (Al) = 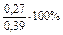 = 69,2%.
= 69,2%.
Задача 2. Чи можлива реакція відновлення TiО2(к) вуглецем при температурах 1000 і 3000 К? Відповідь підтвердіть розрахунками DG0 по рівнянню Гіббса-Гельмгольца.
Розв’язок. Відновлення TiО2 вуглецем протікає по рівнянню:
TiО2(к) + 2С(гр) ® Ti(к) +2СО(г).
Скористаємося рівнянням Гіббса-Гельмгольца: DG0 = DН0 - Т×DS0, і розрахуємо DН0 і DS0 хімічної реакції, користуючись другим наслідком з закону Гесса.
DН0х.р. = 2DН0СО - DН0TiО  = 2×(-110,5) – (-943,9) = - 722,9 кДж.
= 2×(-110,5) – (-943,9) = - 722,9 кДж.
DS0х.р. = (DS0Ti + 2DS0CO) – (DS0TiО 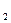 +2DS0C) = 30,7 +2×197,9 – 50,3 - 2×5,7 = 364,8 Дж/ДК = 0,365 кДж/К.
+2DS0C) = 30,7 +2×197,9 – 50,3 - 2×5,7 = 364,8 Дж/ДК = 0,365 кДж/К.
При температурі 1000 К DG0х.р. = -722,9 - 1000×0,365 = - 355,9 кДж.
При температурі 3000 К DG0х.р. = -722,9 - 3000×0,365 = - 1817,9 кДж. Отже, при обох температурних значеннях зазначена реакція можлива.
Задача 3. При роботі гальванічного елемента
| Al | Al2(SO4)3 | Cr2(SO4)3 | Cr |
відновилося до вільного металу 31,2 г хрому. Написати рівняння електродних процесів. На скільки зменшилася маса алюмінієвого електрода?
Розв’язок.
А (-) 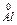 – 3e ® Al3+
– 3e ® Al3+
K (+) Cr 3+ + 3 e ® 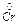
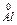 + Cr3+ = Al3+ +
+ Cr3+ = Al3+ + 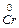
Зменшення маси алюмінієвого анода розрахуємо, застосувавши закон еквівалентів:
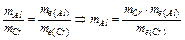 . По формулі: mе (Al) =
. По формулі: mе (Al) = 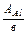 знаходимо еквівалентну масу алюмінію:
знаходимо еквівалентну масу алюмінію: 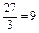 г/моль. Аналогічно розраховуємо еквівалентну масу хрому:
г/моль. Аналогічно розраховуємо еквівалентну масу хрому:
mе(Cr) = 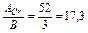 г/моль. Тоді mAl =
г/моль. Тоді mAl = 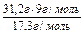 = 11 г.
= 11 г.
18.3. Задачі для самостійного рішення: 1009, 1051, 1053
18.4. Лабораторна робота
Необхідні прилади, устаткування і реактиви: порошок Mg, стружка Al і Ti, гранули Zn, розчини лугів, розведених і концентрованих кислот (HCl, HNO3, H2SO4), розчини K2Cr2O7, FeCl3 і KMnО4, електролізер.








