Тема 17. Властивості неметалів І VА групи (С, Sі)
17.1. Рекомендації до вивчення теоретичного матеріалу
В IVА группу входять 5 елементів (6С, 14Si, 32Ge, 50Sn, 82Pb) з електронною формулою ns2np2. Карбон і силіцій – типові елементи, неметали, германій, станум і плюмбум складють підгрупу германія, це – метали (германій краще віднести до металоїдів, тобто, металоподібних елементів). Незважаючи на те, що кількість валентних електронів у карбона і силіція однакова, за своїми властивостями вони чітко відрізняються один від одного.


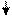
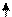












 6C 14Si
6C 14Si
Залежно від числа σ-зв’язків кординаційне число карбону дорівнює чотирьом (sp3-гібридизація: алмаз, CH4, CCl4) трьом (sp2–гібридизація: графіт, бензол, CO32-) або двом (sp-гібридизація: карбін, CO2 CS2). В неорганічних сполуках карбон виявляє ступені окиснення -4 (Al4 C3), +2 (CO), +4 (CO2). Силіцій в сполуках виявляє ступень окиснення (+2), +4 і - 4. Для карбону характерне утворення сполук з подвійними (С=С) і потрійними (С  С) зв’язками за рахунок рπ-рπ-взаємодії; для силіція pπ-pπ–взаємодія не відбувається. Карбон виявляє здатність до утворення гомоланцюгових молекул зі зв’язками С-С лінійного, розгалуженого, циклічного типів (ці чисельні сполуки вивчає органічна хімія). Для силіція утворення ланцюгів ...Si-Si… сильно обмежено.
С) зв’язками за рахунок рπ-рπ-взаємодії; для силіція pπ-pπ–взаємодія не відбувається. Карбон виявляє здатність до утворення гомоланцюгових молекул зі зв’язками С-С лінійного, розгалуженого, циклічного типів (ці чисельні сполуки вивчає органічна хімія). Для силіція утворення ланцюгів ...Si-Si… сильно обмежено.
Слід звернути увагу на алотропію (модифікації) простих речовин: для карбона – це графіт , алмаз, карбін, фуллерени (С60, С70 і інші). Для силіція відомі дві модифікації. При звичайних температурах карбон і силіцій надзвичайно інертні. При високих температурах вони реагують з багатьма металами і неметалами, виявляючи при цьому, в залежності від умов властивості окисника або відновника:
2Mg + Si à Mg2 Si
окисник
Si + H2O + 2 KOH = K2 Si O3 + 2H2О
відновник
Карбіди і силіциди d-металів – тверді жаростійкі сполуки, нерозчинні в кислотах і лугах. Карбіди і силіциди активних металів (s- і p–металів), навпаки, реагують з кислотами або H2O (деякі при нагріванні). При цьому утворюються ацетилен (ацетиленіди, наприклад, CaC2) або метан (метанід, Al4 C3), а при дії кислот на силіциди виділяється силан, SiH4. З гідрогеном карбон утворює численні сполуки, вуглеводні, або гідрогенкарбони (алкани, алкени, ароматичні вуглеводні), які вивчаються в органічній хімії. Гідрогенсилани, або силани, відповідають загальній формулі Sin H2n+2, але на відміну від вуглеводнів, атоми силіція не утворюють довгих ланцюгів (максимально n=8, тобто , до С8 Si18. ) Для карбону отримано оксиди СО, СО2, С3О2,С5О2,С12,О9; для силіція – SiO, SiO2. Слід звернути увагу на будову і хімічні властивості оксидів, зокрема, утворення карбонілів, карбонатів, силікатів, а також на застосування цих сполук.
17.2. Приклади розв’язування типових задач
Задача1. Для отримання вапна використовуються реакція розкладу карбонату кальція. Визначити, при якій температурі починається ця реакція.
Розв` язок: Температура початку реакції визначається за формулою: T = ΔH/ΔS.
Розв’язок. Розрахуємо для реакції: CaCO3  CaO + CO2 значення ΔH i ΔS. Згідно з наслідком із закону Гесса,
CaO + CO2 значення ΔH i ΔS. Згідно з наслідком із закону Гесса, 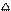 ΔНх.р. = (ΔНСаО + ΔНСаСО3 ) – ΔНСаСО3 .
ΔНх.р. = (ΔНСаО + ΔНСаСО3 ) – ΔНСаСО3 .
ΔHх.р. = (-635,1 + (-393,5)) - (-1206,0) = 177,39 кДж/моль. Аналогічно знаходимо ΔSх.р. :
ΔSх.р. = (39,7 + 231,6) - 92.9 = 160,4 Дж/моль·K = 0,1604 kДж/моль·K .
Температура початку реакції має значення:
T=177,39 / 0,1604 ≈ 1106 K( ≈833°C)
Задача2: Розрахуйте pH 0,01 м розчину К2 СО3.
Розв` язок : Калій карбонат – сіль, яка утворена сильною основою і слабкою кислотою. У водному розчині вона гідролізується за схемою:
К2 СО3 + 2HOH ↔ 2KOH + H2CO3
Для солей такого типу pH розраховують за формулою:
рH = 7 + 1/2(pKк-ти + рСсолі) .
Для H2CO3 (двохосновної кислоти) К1 = 4,5·10-7 (рК =6,35), К2 = 4,7·10-11 (рК = 10,33). Отже, К2 - дуже мала величина і нею можно знехтувати.
Таким чином, рH = 7 + 1/2(6,35 + 2) ≈ 11,2 .
Задача 3. Чому при додавані розчину соди до солей алюмінія випадає білий осад Al(ОH)3, а не карбонат алюмінію.
Розв`язок: Внаслідок гідролізу Na2CO3 утворюється NaOH (лужне середовище).
Na2CO3 + 2HOH à 2NaOH +H2CO3.
Солі алюмінію також гідролізуються, але розчини Al3+ слабокислі. З іншого боку, карбонат алюмінія Al2(CO3)3 – сіль утворена слабою основою і слабою кислотою; солі такого типу підлягають повному гідролізу. Отже, при взаємодії солей алюмінію з розчином Na2СO3 фактично відбувається реакція:
Al3++ 3OH- → Al(OH)3 ↓
Або: 2Al3+ + 3CO32- + 6H2O → Al(OH)3↓ + 3H2CO3
17.3. Задачі для самостійного розв` язку: № 944, 949, 964.
17.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: сухі реактиви – цукрова пудра, стружка деревини, деревне вугілля, CuO, CaCO3; розчини – H2SO4 (конц.), KOH, AgNO3, NH3, мурашина кислота (конц.), розчини хлоридів або сульфатів кальцію, магнію, барію, цинку, кадмію, купруму, феруму (2+), Na2CO3, NaHCO3, K2CO3, KHCO3, Na2SiO3, HCl (1:1 конц.). Апарат Кіппа, штатив з лапкою, пробірка з газовідвідною трубкою, ступка, стаканчики, універсальний папір.
Дослід 1. Одержання аморфного вуглецю і деревного вугілля (витяжна шафа!)
а) В стаканчик на 50 мл насипати 20-25 г цукрової пудри, змочити її ≈2 мл води і додати 10-12мл концентрованої сірчаної кислоти. Обережно перемішати скляною палочкою.Через 1-2 хв починається енергійна екотермічна реакція з виділенням газуватих продуктів:
С12 H22 O11 + 2H2SO4 = 13H2O↑ + 2SO2↑ + 11C + CO2 ↑
б)“суха перегонка деревини“: пробірку з газовідвідною скляною (!) трубкою заповнюють на ¾ дрібно нарізаною деривиною і закріплюють горизонтально в штативі з лапкою. Закривають пробірку с пробкою зі скляною трубкою і рівномірно прогрівають пробірку невеликим полум’ям, стежачи за перетворенням деревини. Підпаліють газ, що виділяється через трубку. Після охолодження пробірки чорний продукт (вугілля) збирають для виконання наступного досліду.








