Дослід 8. Відновні властивості тіосульфату натрію Na 2 SO 3
У чотири пробірки наливають окремо розчин Cl2 (хлорної води), розчини KMnO4, K2Cr2O7 i Ш2 (йодної води). Розчини KMnO4 і K2Cr2O7 підкислюють H2SO4. По краплям додають у кожну пробірку розчин тіосульфату Na2S2O3. Спостерігають зміну забарвлення розчинів, складають рівняння кожної реакції, маючи на увазі, що сильними окисниками (перші три пробірки) тіосульфат окислюється до NaHSO4, а більш слабкими (І2) - до тетратіонату Na2S4O6.
15.5. Список рекомендованої літератури
1. Михайленко Я.И. Курс общей и неорганической химии. – М.: Высш. шк., 1966. - С.554-589.
2. Ахметолв Н.С. Общая и неорганическая химия. – М.: Высш. шк., 2001. – С.338-372.
Тема 16. Властивості неметалів VА групи ( N, P, As , Sb)
16.1. Рекомендації до вивчення теоретичного матеріалу
Елементи VА групи відносяться до p-електронних аналогів (валентними електронами є ns2np3 ), але типовими неметалами є лише нітроген і фосфор. Арсен, стибій – металоїди (тобто, “подібні до металів”), а бісмут виявляє переважно металічні властивості. Розподіл електронів по квантовим коміркам:
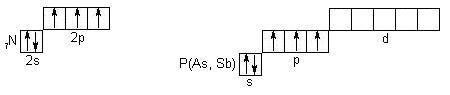
В обох елементів на p-орбіталях розташовані по 3 неспарених електрона, тобто для обох елементів принципово можливі ступені окиснення від -3 до +5 . Але властивості нітрогену (азоту) різко відрізняються від властивостей фосфору. Для досягнення завершеного октету нітроген приймає на 2p-орбіталь електрони з утворенням нітридів (Li3N, Na3N),сполук з двохелектроними зв’язками (NH3, N2,NF3), амідів (NaNH2), імідів(Na2NH). У деяких випадках відсутній завершений октет (NО, NО2), неспарений електрон делокалізується по всій системі зв’язків молекули .
Нарешті, на відміну від фосфору, арсену і стибію, для нітрогену характерна pπ-pπ-взаємодія, тобто, нітроген утворює подвійні і потрійні зв’язки, наприклад, в азидогідрогеновій кислоті HN3 , нітрилах:
Н-N=N≡N CH3-C≡N
Формальні ступені окиснення нітрогену :
-3 -2 -1 +1 +2 +3 +4 +5
NH3 N2H4 NH2OH N2O NO N2O3 NO2 N2O5
Молекулярний азот N2 хімічно мало активний, що обумовлено наявністю потрійного зв’язку між атомами нітрогену: N≡N (∆H0298 = 945кДж/моль). Але при високих температурах азот окиснює метали і неметали з утворенням нітридів:
3Mg + N2 = Mg3N2; 2B + N2 = 2BN
Слід уважно розглянути властивості сполук нітрогену з різними ступенями окиснення, звернувши особливу увагу на їх окисно-відновні властивості. Для нітрогену +3 і +5 існують кислоти HNO2 (слабка) і HNO3 (сильна) відповідно. Нітритна кислота і її солі виявляють окисно-відновну подвійність. Нітратна кислота HNO3 – сильний окисник , окиснює більшість металів і неметалів. Суміші HNO3 і HCl і особливо HNO3 з HF окиснюють навіть Au , Pt , Nb , Zb та інші метали.
Як зазначалось, для фосфора (як і для інших елементів VА групи) pπ- pπ-взаємодія нехарактерна . Найбільш поширені сполуки, у яких фосфор виявляє ступінь окиснення : -3 (PH3), +1 (Na[PO2H2]) ; +3 (PCl3, P2O3 , H3PO3) і +5 (P 2O5, H3PO4 , PCl5). Елементарний фосфор існує у різних модифікаціях (чорний, красний, білий). Хімічно найактивніша біла модифікація. Фосфор (Р0) виявляє властивості як окисника (P2 + 6Na = 2Na3P), так і відновника (P2 + 3Cl2 = 2PCl3). У ступені окиснення +1 фосфор представлений фосфіновою кислотою і її солями - фосфінатами, або гіпофосфінатами. Фосфінати використовують у процесі хімічного нікелювання :
Ni2+ + [PO+12H2]- + 2H2O = NI0 + P+5O3-4 + 4H+ + H20
Оксиди фосфору (P2O3 і P2O5) є андігридами кислот – фосфонової H2[P+3O3H] і фосфатної (H3P+5O4 - ортофосфатна, HP+5O3 - метафосфатна, H2P2O7 - пірофосфатна). Відомі поліфосфатні кислоти Hn+2PnO3n+1 , солі яких називають поліфосфатами.
Найбільш характерними ступенями окиснення для арсена і стібія є +3 +5. Гідрогенові сполуки AsH3 і SbH3 менш стійкі , ніж аналогічні сполуки фосфін PH3 і аміак NH3. Оксиди As2O3(Sb2O3) і As2O5(Sb2O5 ) являють собою андігриди кислот. Обидва елементи і деякі їх сполуки виявляють напівпровідникові властивості.
16.2. Приклади розв’язування типових задач
Задача 1. Яким чином можна відрізнити розчин хлориду амонію від хлориду натрію ?
Розв’язок. Хлорид амонію NH4Cl утворений взаємодією слабкої основи NH4OH з сильною кислотою, тому в розчині він гідролізується за схемою :
NH4Cl + HOH = NH4OH + HCl
NH4+ + HOH = NH4OH + H+ (pH<7)
Тобто, у розчині NH4Cl - кисле середовище, універсальний індикаторний папірець змінить забарвлення від жовтого до червоного. Хлорид натрію гідролізу не підлягає. Крім того, розчин NH4Cl легко відрізнити від розчину NaCl по реакції з лугами (при нагріванні):
NH4Cl + NaOH →t NH3 + H2O + NaCl
Аміак визначають за запахом, а також лакмусовим або індикаторним папірцем. При прожарюванні зразка хлориду амонію утворюються леткі сполуки :
NH4Cl → NH3↑ + HCl↑
Хлорид натрію при прожарюванні не розкладається. Забарвлення полум’я при внесенні в нього NaCl - жовте, а солей амонію – безбарвне.
Задача 2. Гідроксиламін NH2OH – сильний відновник, але він може виявляти і властивості окисника . Напишіть відновні реакції, які підтверджують окисно-відновну подвійність гідроксиламіну.
Розв’язок.
а) 2 NH2OH + І02 + 2KOH → N02 + 2KІ-1 + 4 H2O
відновник
б) 2NH2OH + 4Fe+2SO4 + 3H2SO4 → 2Fe2(SO4 )3 + (NH4)2SO4 + 2H2O
окисник
Задача 3. При згорянні 3г фосфору утворилося 6,87г оксиду, густина пари якого відносно повітря 9,8 . Який оксид утворився ?
Розв’язок . За умовою задачі утворилося 6,87 г оксиду, тобто, в реакцію вступило 3,87г О2 . Знаходимо відношення х : у в формулі оксиду PxOy :
х : y = 3/31 : 3,87/16 = 0,0968 : 0,242 = 2 : 5
Найпростіша формула оксиду P2O5 ; для неї молекулярна маса складає 2·31+5·16 = 142 г/моль. Істінна молекулярна маса складає М = 9,8·dпов. = 9,8· 29 = 284,2г/моль .Отже формула оксида P4O10.
16.3. Задачі для самостійного розв’язку: 901, 902, 917
16.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: сухі речовини – NaNO2 , NH4Cl + Ca(OH)2 (1:1), NH4Cl, NH4NO3 , (NH4)2SO4, сульфати або хлориди гідразину,гідроксиламіну, NaNO2, Cu (стружка); розчини NH4Cl (насич.), NH3(конц.), HCl(конц.), йодна вода, HNO3 (розб., конц.), H2SO4, H3PO4, KOH, NaOH, KІ, FeSO4, KSCN, KMnO4 , NaNO2, Na3PO4, NaH2PO4, Na2HPO4, розчини солей кальцію, магнію, плюмбуму, срібла, молібдата амонію. Штатив з лапкою, пробірка з газовідвідною трубкою, кристалізатор з водою, індикаторни папір, склянні палички.
Дослід 1. Одержання азоту
В пробірку насипають 2 г нітриту натрію NaNO2 , додають 4-5 мл насиченого розчину NH4Cl. Закривають пробірку пробкою з газовідводною трубкою, закріпляють в штативі з лапкою горизонтально і обережно прогрівають суміш реагентів. Через 1-2 хвилини збирають газ у широку пробірку під водою у ванні . Через деякий час закривають пробірку, виймають із ванни і перевіряють наявність N2 палаючого трісочкою та вапняною водою (полум’я згасає, а вапняна вода не змінюється ) . Написати рівняння реакцій , що відбуваються .
Дослід 2. Одержання ам оніаку
Суху суміш NH4Cl і Ca(OH)2 (1:1) насипають у пробірку з газовідводною трубкою, закріпляють пробірку горизонтально у штативі і нагрівають її повільно до виділення NH3. Виділення NH3 перевіряють по характерному запаху, індикаторним або фенолфталеїновим папірцем .
Дослід 3. Взаємодія ам оніаку з кислотами
Змочують одну скляну паличку концентрованим розчином NH3 у воді, а другу концентрованим розчином HCl і підносять одну паличку до іншої. З’являється білий дим хлориду амонію .
Дослід 4. Термічний розпад солей амонію
Нагрівають у фарфорових тіглях на полум’ї пальника невелику кількість амонійних солей : HN4Cl, HN4NO3, (HN4)2SO4 до повного їх розкладу . Записують рівняння відповідних реакцій .








