Тема 15. Властивості неметалів VIА групи ( O, S, S e, Te)
15.1 Рекомендації до вивчення теоретичного матеріалу
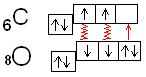
Електронна формула  елементів VI А групи - ns²np4 , тобто вони відносяться до сімейства р-електронних аналогів. Як і для елементів VII групи, перший представник - оксиген 8О - не має вакантних d-орбіталей, на відміну від елементів S, Se i Te, і тому за властивостями різко відрізняється від останніх.
елементів VI А групи - ns²np4 , тобто вони відносяться до сімейства р-електронних аналогів. Як і для елементів VII групи, перший представник - оксиген 8О - не має вакантних d-орбіталей, на відміну від елементів S, Se i Te, і тому за властивостями різко відрізняється від останніх.

Як і флуор, оксиген - сильний окисник; він утворює сполуки майже з усіма елементами (крім He, Ne, Ar). По електронегативності оксиген поступається лише флуору.
У більшості сполук ступінь окиснення оксигену дорівнює -2. Але формальна ступінь окиснення може бути і іншою: -1 ( в пероксидах, озонідах), а також +1, +2 і +4 в сполуках зі зв'язком O-O (Н.С Ахметов «Общая и неорганическая химия. – М. : Высш. шк., 2001-743с.) H2O-2 ; KO 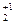 ; F2O
; F2O 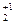 ; F2O+2; O
; F2O+2; O 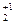 [PtF6]; O3( O+4 O2).
[PtF6]; O3( O+4 O2).
Слід звернути увагу на кислотно-основні властивості оксидів (основні, кислотні, амфотерні), їх розчинність у воді, кислотах, лугах. У ступені окиснення -1 (пероксиди) оксиген може виявляти властивості як окисника, так і відновника:
2KI-1 + Na2O 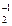 + 2H2SO4 = I
+ 2H2SO4 = I 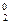 + Na2SO4 + K2SO4 + 2H2O-2
+ Na2SO4 + K2SO4 + 2H2O-2
окисник
2КMn+7O4 + 5H2O 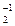 + 3H2SO4 = 2Mn+2SO4 + 5O
+ 3H2SO4 = 2Mn+2SO4 + 5O 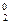 + K2SO4 + 8H2O.
+ K2SO4 + 8H2O.
відновник
Сильним окисником є озон, який окиснює навіть ртуть(меркурій) і срібло(арґентум): 8Ag + 2O3 = 4Ag2O + O2.
Елементи сульфур, селен і телур, як і оксиген, мають 6 валентних електронів, але відрізняються від нього наявністю вакантної d-орбіталі і, як наслідок, проявом парної ступені окиснення: -2, +2, +4, +6, що можна пояснити участю в утворені хімічних зв’язків двух непарних електронів, а також однієї або двох електронних пар.
Сульфур (сірка) - типовий неметалічний елемент; по електронегативності (2,5) вона поступається лише галогенам, оксигену і нітрогену. Всі три елементи - S, Se, Te - існують у різних модифікаціях, які відрізняються не тільки структурою, а насамперед, фізичними і хімічними властивостями. З металами вони реагують при різних температурах, утворюючи сульфіди, селеніди і телуриди. Для сульфуру характерно утворення гомоланцюгів -S(-S)n-, наприклад, полісульфіди натрію: Na2S + (n-1)S = Na2Sn. У природі розповсюдженим є мінерал пірит FeS2, який являє собою персульфід Fe(II). Полісульфіди і, насамперед, персульфіди, як і пероксиди, виявляють відновні і окисні властивості і також диспропорціонують:
Na2S 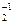 = Na2S-2 + S0
= Na2S-2 + S0
Гідрогенові сполуки (H2Е, H2E2) - гази, а у розчині - слабкі кислоти. Найбільш стійкими оксигеновими сполуками є ЕО2, і ЕО3 - ангідриди кислот Н2ЕО3(слабкі) і Н2ЕО4(сильні) (E = S, Se, Te)
Варто звернути увагу на окисно-відновні властивості елементів у ступені окиснення +4 (окисно-відновна подвійність) і +6 (сильні окисники), а також відмінності у взаємодії з металами сірчаної (сульфатної) кислоти різної концентрації. На практиці часто використовується сульфурвміщуючі кислоти і їхні солі незвичайного, на перший погляд, складу:
S(+4): H2S2O5 ; Na2S2O5( метабісульфіт)
H2S2O4 (у вільному стані не існує); Na 2S2O4 (сульфоксилат)
S(+6) H2S2O7 (H2SO4 · SO3)—піросірчана (піросульфатна) кислота
H2SО5 (НООSO2OH)—пероксосульфатна кислота (кислота Каро)
H2S2О8 ( НООSO2OОH)—персульфатна кислота
H2SхО6 (х = 2 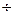 6) (НОSO2 -(S)x-2-SO2OH)—політіонові кислоти
6) (НОSO2 -(S)x-2-SO2OH)—політіонові кислоти
Як відновник, часто використовується тіосульфат(гіпосульфіт) натрію, Na2S2O3 , який має структуру:
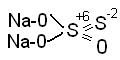
15.2. Прик лади розв’язку типових задач
Задача 1. Наважку технічної солі BaCl2·2H2O 0,5965г обробляли надвишком сульфатної кислоти. Маса осаду барія сульфату після прожарювання складала 0,4646г. Визначте вміст чистого кристалогідрату BaCl2·2H2O в технічній солі.
Розв´язок: Аналіз солі барію відбувається згідно з рівнянням:
BaCl2·2H2O + H2SO4 = BaSO4↓ + 2HCl + 2H2O
244,30 233,40
Таким чином, 233,40г BaSO4 відповідають 244,30г BaСl2·2H2O
0,4646г BaSO4 х г BaСl2·2H2O
х = (0,4646·244,30)/233,40 = 0,4862г BaСl2·2H2O
Вміст чистого BaСl2·2H2O в технічній солі складає:
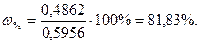
Задача 2. Визначте [H+] в 0.025 м розчині H2S.
Розв´язок: Розчин H2S у воді являє собою слабку кислоту, для якої К1 = 1·10-7, а К2 = 1,2∙10-18. Отже практично всі іони Н+ утворюються за рахунок дисоціації кислоти по першій стадії:
H2S ↔ HS+ + S-
а рівняння константи дисоціації має вигляд:
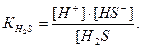
Якщо позначити [H+] = [HS-] = x, то отримаємо К = 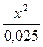
Звідси х = [H+] = 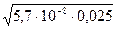 = 3,77·10-5 моль/л
= 3,77·10-5 моль/л
Задача 3. Відносна електронегативність (χ) у оксигена 3,5, а у карбона 2,5. Незважаючи на це, розподіл зарядів в молекулі чадного газу такий: δ-СО+δ . Як пояснити такий розподіл зарядів з точки зору метода валентних зв'язків(ВЗ)?
Розв'язок: Розподіл електронної густини при утворені молекули СО можна показати графічно:
В молекулі СО два зв'язки утворюються по ковалентному механізму, а один - по донорно-акцепторному (дативному) механізму. В останньому випадку донором електронної пари є оксиген, акцептором - атом карбону. Отже, розподіл електронної густини такий: 
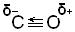
15.3. Задачі для самостійного розв’язку
15.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: сухі реактиви – MnO2, KMnO4, Na2SO3 , порошки Fe, S; розчини – Na2SO3 , H2O2 (3% i 30%), Na2S, Na2S2O3 , Pb(NO3)2 , KOH, H2SO4 , HCl(розб.,конц.), KMnO4 , K2Cr2O7 , сульфати або хлориди цинку, мангану, кадмію, купруму, нікелю; KІ; водні розчини хлору, брому, йоду. Штатив з лапкою.
Дослід 1. Одержання кисню О2 і сірки S
а) У широку пробирку або циліндр наливають ≈5 мл гідроген пероксиду Н2О2 (30%) і додають декілька кристалів каталізатора МnО2 або КМnO4 (обережно, додавати невеликими порціями!). Спостерігають бурхливу реакцію диспрорцінування Н2О2. Виділення О2 контролюють за допомогою тліючої трісочки, яка спалахує в атмосфері О2.
б) Для одержання О2 в пробірку насипають ≈1г КMnO4 і сильно прожарюють у полум’ї пальника. Виділення О2 контролюють, як і в попередньому досліді. Після охолодження пробірки добавляють в неї 4-5 мл води, перемішують. Спостерігають утворення зеленого розчину К2MnO4 і бурого осаду MnO2.
в) Одержати сірку можна кількома способами. У пробірку наливають 2-3 мл розчину Na2SO3, підкислюють розчином H2SO4 , додають розчин Na2S2O3 і далі - 1-2 мл сульфатної кислот








