Тема 14. Властивості неметалів VIIА групи (F, Cl, Br, I)
14.1. Рекомендації до вивчення теоретичного матеріалу
Елементи VIIА групи (F, Cl, Br, I, At) відносяться до сімейства р-електронних аналогів і мають загальну формулу ns2np5. В ряду від F до At радіус атомів зростає, а енергія іонізації зменшується, і, як наслідок, неметалічні властивості слабшають. У незбудженому стані розподіл електронів по квантовим коміркам такий:
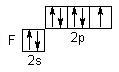
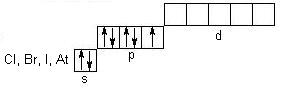
Отже, у флуора (фтора) немає вакантної d-орбіталі, тому для нього можлива тільки негативна ступінь окиснення: - 1 (HF, NaF). Для Cl, Br, I найбільш характерними є ступені окиснення: - 1, 0, +1, +3, +5, +7. Флуор – один із самих сильних окисників (окисно-відновний потенціал E0F2\2F - = +2,87 B). В атмосфері флуору згоряють більшість металів і неметалів, органічні речовини. Флуор окиснює навіть інертні гази (за винятком гелію, неону і аргону):
Xe + 2F2 = XeF4; ∆H0 = - 252KДж/моль.
З іншими галогенами флуор утворює інтергаліди (ClF, ClF3, BrF5, IF5, IF7). В оксиді флуору F2O оксиген має формальну ступінь окиснення +2, з гідрогеном флуор утворює газ HF, водний розчин якого являє собою слабку кислоту (HF)2 – димер (для 0,1н. HF α = 0,08 ). На відміну від гідрогенових сполук інших галогенів, для H2F2 відомі «кислі» солі (KHF2), а також комплексні сполуки типа флуорогідрогенатів K[H2F3], K[H3F4], K[H4F5]. Комплексні флуориди – численні, координаційне число металів в них 4, 6, 7, але може підвищуватись до 8 і навіть 9: K2[BeF4], K3[AlF6], K2[NbF7], K2[WF8], K2[ReF9].
Слід звернути увагу на відмінності властивостей хлору, брому і йоду від властивостей флуору. Їх окисно-відновні потенціали дорівнюють +1,36; +1,08; +0,53 В відповідно; отже, в цьому ж ряду окислювальні властивості галогенів слабшають. У нульовій ступені окиснення ці галогени виявляють окисно-відновну подвійність, наприклад:
Cl02 + H2O ↔ HCl-1 + HOCl+1
Галіди металів, як правило, добре розчиняються у воді і деяких органічних розчинниках, але хлориди, броміди та йодіди Ag+ i [Hg22+] нерозчинні (зазначимо, що AgF i Hg2F2 , навпаки, добре розчиняються у воді). Гідрогенові сполуки (НЕ) – гази, водні розчини яких відомі, як сильні кислоти: α для 0,1н. розчинів HCl, HBr, HI( складає відповідно 92,6; 93,5; 95%. Відомими оксигеновими сполуками є: E2O, EO2 (оксид E2O3 не існує ), ЕО3 (Е2О5 не існує) і Е2О7; вони являють собою ангідриди кислот НОЕ, НЕО2, НЕО3, НЕО4 (Е – галоген). Оксиди ClO2 i ClO3 у водних розчинах диспропорціонують за схемами:
2Cl+4O2 + H2O ↔ HCl+3O2 + HCl+5O3 ;
2Cl+6O3 + H2O ↔ HCl+5O3 + HCl+7O4 .
Kислоти НОЕ – слабкі, НЕО2 - нестійкі, НЕО3, НЕО4 являють собою сильні кислоти. Їх солі використовують як окисники, причому, окислюючи властивості зростають в ряду від 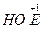 до
до 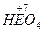 . Хлориди, броміди та йодиди входять як ліганди до складу комплексних сполук, але координаційне число металів у більшості не перевищує 4 та 6.
. Хлориди, броміди та йодиди входять як ліганди до складу комплексних сполук, але координаційне число металів у більшості не перевищує 4 та 6.
14.2. Приклади розв’язку типових задач
Задача 1. При електролізі розчину NaCl на аноді виділилося 2,24 л хлору. Які продукти і у якій кількості утворилися на катоді і у розчині?
Розв’язок. Схема електролізу водного розчину NaCl:
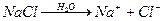 ;
;
На аноді: 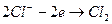 ;
;
На катоді: 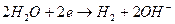 ;
;
Сумарно: 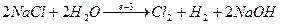 .
.
Згідно з сумарним рівнянням, при утворенні 1 моля Cl2 (22,4 л) на катоді виділяється 1 моль Н2 (22,4 л), а в розчині утворюється 2 моля NaOH (тобто, 40·2 = 80 г). За умовами задачі виділилося 2,24 л Cl2 , що складає 2,24:22,4 = 0,1 моля. Отже, об’єм Н2 дорівнює 2,24 л, а маса NaOH – 8г.
Задача 2. У трьох склянках без етикеток знаходяться розчини KCl, KBr, KJ. Запропонуйте, яким чином можна визначити кожну із солей.
Розв’язок. Реагентом на галогенiди є розчин AgNO3, при додаванні якого випадають осади: AgCl (білий), AgBr (блідо-жовтий), AgJ(жовтий). При цьому AgCl добре розчинний в аміаку з утворенням комплексної сполуки [Ag(NH3)2]Cl, а AgBr та AgJ нерозчинні в аміаку. Крім того, відокремити KBr i KI від KCl можна за допомогою окислювачiв (хлорна вода, KMnO4):
2Br - + Сl2 = Br2 + 2Cl –(жовтий колір);
2I- + Cl2 = I2 + 2Cl –(коричнево-бурий колір).
Вільний йод виявляють крохмалем, який забарвлюється в синій колір. Солі Cu2+ з іоном J– утворюють солі закису міді з виділенням вільного йоду (Cl – i Br – не дають відповідної реакції):
2CuSO4 + 4KI → 2Cu2J2↓ + I2 + 2K2SO4.
Солі Рb2+ утворюють з солями I- жовтий осад PbI2 (осади PbCl2 і PbBr2 білого кольору).
Задача 3. Порівняйте рН 0,1н розчинів HCl i HF.
Розв’язок. Хлоридна (соляна) кислота – сильна кислота. Тому рН = -lgCHCl = -lg10-1 = 1.
Плавикова кислота HF – слабка (KHF = 6,6·10-4; рК = 3,18). У такому випадку 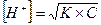
 , а рН визначають за формулою:
, а рН визначають за формулою: 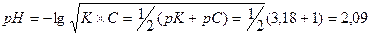
14.3. Задачі для самостійного розв’язування: 823, 824, 831.
14.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: сухі реактиви – MnO2, KMnO4, K2Cr2O7, KBr, KI, I2, CuCl2·2H2O, KF; розчини – KF, KCl, KBr, KI, Cl2, Br2, AgNO3, HCl(конц., розб.), NH3, Pb(NO3)2, CaCl2, KMnO4, K2Cr2O7, CuSO4, KClO3, KBrO3, KIO3, H2SO4, Hg(NO3)2, FeCl3, етиловий спирт.
Дослід 1. Одержання хлору, брому, йоду (виконується у витяжній шафі! ).
а) У три пробірки насипають невелику кількість порошків MnO2, KMnO4, K2Cr2O7 і додають близько 1мл концентрованої хлоридної кислоти HCl (ρ=1,19г/см3). При необхідності злегка підігрівають. Утворення хлору спостерігають на фоні білого паперу. Написати рівняння відповідних реакцій і підрахувати Е.Р.С.
б) У одну пробірку насипають невеличку кількість кристалічного KBr, а у другу – KI, додають у кожну з них на кінчику шпателя порошку MnO2, перемішують і додають кілька крапель концентрованої H2SO4, злегка підігрівають. Спостерігають виділення газуватих брома і йода, відмічають їх колір. Написати рівняння відповідних реакцій.
Дослід 2. Властивості галогенів.
а) До розчинів KI, KBr додають 1-2 мл хлорної води. Спостерігають утворення I2 i Br2 по зміні забарвлення розчинів.
б) До розчинів KCl i KI додають бромну воду. Записують спостереження , складають рівняння реакцій і дають пояснення, порахувавши Е.Р.С.
в) У дві пробірки поміщують невелику кількість кристалічного йоду. У першу пробірку додають приблизно 2 мл води, а у другу стільки ж спирту. Відмічають різну розчинність I2. У пробірку з водою і I2 додають декілька крапель розчину КI, спостерігають розчинення кристалічного йоду. Дати пояснення, записавши у останньому випадку рівняння реакції утворення комплексної сполуки.








