Т е м а 13. Електроліз. Нанесення гальванопокриттів
13.1. Рекомендації до вивчення теоретичного матеріалу
При вивченні даної теми і виконанні завдань по ній необхідно звернути увагу на наступне:
Електролізом називається сукупність процесів, що протікають на електродах при проходженні постійного електричного струму через розплав або розчин електроліту.
Як і в гальванічному елементі, електрод, на якому при електролізі відбувається відновлення, називається катодом, а електрод, на якому здійснюється процес окиснення, - анодом.
Для здійснення процесу електролізу збирають установку, що складається з джерела постійного струму, електродів, ємності (електролізера), що містить розчин або розплав електроліту.
Електроліз протікає не при будь-якій різниці потенціалів, а при цілком визначеній, яка називається потенціалом розкладання (Ерозкл..). Останній чисельно дорівнює Е.Р.С. гальванічного елемента, побудованого на продуктах електролізу. Можна розрахувати також потенціал розкладання по формулі: Е розкл. = 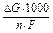 .
.
При електролізі розплаву на аноді відбувається окиснення аніона, а на катоді – відновлення катіона. При електролізі розчинів молекули розчинника (зокрема, молекули води) можуть брати участь у процесах окиснення-відновлення відповідно до схем:
Анод: а) рН 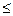 7 2Н2О –4е ® О2 + 4Н+ (Е0 = 1,23 В)
7 2Н2О –4е ® О2 + 4Н+ (Е0 = 1,23 В)
б) рН > 7 4ОН- - 4е ® 2Н2О + О2 ( Е0 = 0,40 В)
Катод: а) рН < 7 2Н+ + 2е ® Н2 (Е0 = 0 В)
б) рН 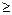 7 2Н2О + 2е ® Н2 + 2ОН- (Е0 = -0,83 В)
7 2Н2О + 2е ® Н2 + 2ОН- (Е0 = -0,83 В)
Тому варто керуватися наступним правилом: на катоді в першу чергу протікає той процес, потенціал якого більше (тобто, зміщений у більш позитивну область); на аноді в першу чергу протікає той процес, потенціал якого менше. З урахуванням вищенаведених правил можна виділити три групи металів у ряді напруги:
I – від Li до Mn – іони цих металів у водних розчинах не відновлюються (замість них відновлюються молекули води);
II – від Zn до Sn – іони металів відновлюються одночасно з молекулами води;
III – метали, що розташовані після водню – іони цих металів легко відновлюються на катоді, молекули води практично не відновлюються.
Слід враховувати також можливість окиснення матеріалу анода (активний анод), а також процеси поляризації електродів, перенапруги і т.п., що можуть змінити напрямок протікання процесу електролізу (більш докладно з цим необхідно познайомитися по підручнику Фролова: гл. «Реальні електрохімічні процеси»).
Наприклад, при електролізі водних розчинів хлоридів (NaCl, CuCl2, SnCl2 та інш.) на інертному аноді можливе протікання наступних процесів:
а) 2Cl- - 2ē → Cl2↑ (E0 Cl2/2Cl- = 1,36 B);
б) 2H2O - 4ē → O2↑ + 4H+ (E0О2+4H+/2H2O =1,23B).
Теоретично повинен відбуватися процес (б), його потенціал розкладання менший. На практиці, внаслідок перенапруги виділення О2 на величину від 0,5 до 1 В, потенціал розкладання Н2О підвищується, а потенціал окиснення іону Cl- залишається незмінним. Отже, в реальних умовах відбувається процес (а), виділяється хлор.
Слід мати на увазі, що реальний потенціал розкладання (ΔЕпракт.) завжди вище теоретичного( ΔЕ теор.) :
ΔЕпракт. = ΔЕтеор. + ІR + ΔEполяр. + ΔЕконт. ,
де ΔЕполяр. - різниця потенціалів внаслідок протікання поляризаційних процесів: ΔЕконт. – падіння потенціалів на контактах (контактна різниця потенціалів). Наявність побічних процесів призводить до втрат електрики.
Нижче наведені значення потенціалів перенапруги виділення Н2 і О2 на електродах, виготовлених із різних металів (ΔUH2 і ΔUO2):
Т а б л и ц я 8
Потенціали перенапруги виділення Н2 і О2 на електродах із різних матеріалів
| Значення ΔUH2 | |||||
| Матеріал електрода | ΔUH2, В | Матеріал Електрода | ΔUH2, В | Матеріaл електрода | ΔUH2 , В |
| Pt (чорн.) Pt (гладк.) Au W Ag | 0,00 0,09 0,15 0,22 0,30 | Ni Bi Fe Cu Sb Al | 0,31 0,40 0,45 0,36 0,60 0,70 | Zn Sn Cd Hg Pb C (графіт) | 0,70 0,75 0,80 1,10 1,16 0,65 |
| Значення ΔUO2 | |
| Матеріал | ΔUO2, В |
| Pt (чорн.) Pt (гладк.) Fe Ni Pb | 0,25 0,45 0,25 0,06 0,31 |
Кількісні розрахунки процесів електролізу можна робити за допомогою законів Фарадея:
1. Маси або об¢єми речовин, що виділилися на електродах прямо пропорційні кількості електрики, що пройшла через електроліт і хімічному еквіваленту речовини:
m= k × I × 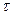 = k × Q, оскільки k =
= k × Q, оскільки k = 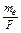 , то m =
, то m = 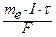 ;
;
для газів V = 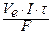 .
.
2. При проходженні через різні електроліти однакової кількості електрики на електродах виділяються маси речовин, пропорційні їхнім хімічним еквівалентам:
Якщо Q = const, то 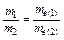 , де m – маса речовини, що утворилась чи підляглась електролізу.
, де m – маса речовини, що утворилась чи підляглась електролізу.
mе– його еквівалентна маса, г;
I – сила струму, А;
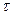 – час, с;
– час, с;
F – число Фарадея (96500 Кл/моль (А×с/моль); або 26,8 А×год/моль, якщо час виражений у годинах);
Q – кількість електрики, що прошла через електроліт, Кл;
k – електрохімічний еквівалент, що чисельно дорівнює масі речовини (г), що виділилась при проходженні одного кулона електрики;
V – об¢єм газоподібної речовини, що утворилась при електролізі;
Vе – еквівалентний об¢єм газоподібної речовини.
На практиці внаслідок протікання побічних процесів, що відбуваються на електродах, утворюється менше речовини, чим відповідає розрахунковим формулам. Для характеристики істинної кількості речовини, що виділилась на електродах, використовують величину 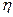 (греч. «ета»), називану виходом по струму:
(греч. «ета»), називану виходом по струму:
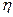 =
= 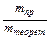 ×100%.
×100%.
13.2. Приклади рішення типових задач
Задача 1. Електричний струм силою 6 А пропускали через водний розчин натрійм нітрату протягом 1,5 години. Написати рівняння процесів, що відбуваються при електролізі з інертним анодом. Які речовини й у якій кількості виділяються на електродах?
Розв’язок. У водному розчині натрій нітрат дисоціює за схемою: NaNO3ÛNa+ + NO3-
К (-) А (+)
Na+, H2O NO3-, H2O
Стандартний електродний потенціал системи Na+ + e ® Na0 дорівнює (-2,71 В). Стандартний електродний потенціал відновлення води (-0,41 В). Тому на катоді буде відбуватися електрохімічне відновлення води, що супроводжується виділенням водню: 2Н2О + 2е ® Н2 + 2ОН-, а іони Na+ і ОН- будуть накопичуватися в катодному просторі. На аноді буде відбуватися електрохімічне окиснення води, що приводить до виділення кисню: 2Н2О –4е ® О2 + 4Н+, а іони NO3-, Н+ будуть накопичуватися в анодному просторі. Таким чином, одночасно з виділенням водню і кисню при електролізі водного розчину натрій нітрату утворюється натрій гідроксид (у катодному просторі) і азотна кислота (в анодному просторі), якщо між катодом і анодом розташована діафрагма.
Сумарне рівняння: 4NaNO3 + 6Н2О 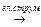 2Н2 + О2 + 4NaOH + 4HNO3
2Н2 + О2 + 4NaOH + 4HNO3
Обчислимо кількість в кисню і водню по першому законі Фарадея:
V = 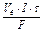 . Оскільки при нормальних умовах еквівалентний об¢єм водню дорівнює 11,2 л, кисню – 5,6 л, а
. Оскільки при нормальних умовах еквівалентний об¢єм водню дорівнює 11,2 л, кисню – 5,6 л, а 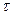 = 1,5 години, то одержуємо:
= 1,5 години, то одержуємо:
V 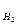 =
= 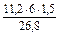 = 3,76 л; V
= 3,76 л; V 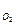 =
= 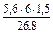 = 1,88 л
= 1,88 л
Задача 2. При електролізі розчину купрум сульфату на аноді виділилося 168 см3 кисню при н.у. Скільки грамів міді виділилося на катоді?
Розв’язок. Використовуючи закон еквівалентів, запишемо: 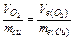 .
.
Отже, маса міді : mCu = 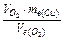 =
= 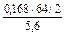 = 0,96 г. (Об¢єм кисню виражаємо в системі СІ: 168 см3 = 168 мл = 0,168 л).
= 0,96 г. (Об¢єм кисню виражаємо в системі СІ: 168 см3 = 168 мл = 0,168 л).
Задача 3. Електричний струм силою 2,5 А, проходячи через розчин електроліту, за 30 хвилин виділяє з розчину 2,77 г двовалентногоого металу. Визначите, який це метал.
Розв’язок. Використовуючи закон Фарадея (m 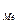 =
= 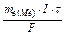 ), розрахуємо еквівалентну масу цього металу по формулі:
), розрахуємо еквівалентну масу цього металу по формулі:
m 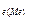 =
= 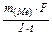 ; m
; m 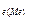 =
= 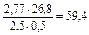 г/моль. Еквівалентна маса пов'язана з атомною масою співвідношенням: m
г/моль. Еквівалентна маса пов'язана з атомною масою співвідношенням: m 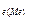 =
= 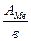 , з якого випливає: АМе = m
, з якого випливає: АМе = m 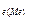 × у = 59,4×2 = 118,5 г/моль. Даний метал – олово (Sn).
× у = 59,4×2 = 118,5 г/моль. Даний метал – олово (Sn).
13.3. Задачі для самостійного рішення 689, 690, 695, 709
13.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: прилад для електролізу: U-образна скляна трубка, электролізер (для проведення НДРС), графітовий і мідний електроди, випрямляч, розчини: сірчаної кислоти, хлориду олова (2+), іодиду калію, сульфату натрію, складні (рецептурні) розчини (див. дослід 5).








