Рідинна корозія – це корозія в середовищі рідин-неелектролітів (бензин, гас, толуол і ін.).
Найбільший збиток техніці і промисловості наносить електрохімічна корозія. Механізм контактної корозії пов'язаний з виникненням мікро- чи макрогальванопар:
| (-) А Ме1 | Д | Ме2 К (+), |
де Д – деполяризатор (середовище). (Дивіться тему “Гальванічні елементи”). При цьому анодний процес – процес окиснення (руйнування) більш активного металу, а катодний – процес відновлення, причому деполяризатором-окисником виступають іони Н+ (у кислому середовищі: 2Н+ + 2е ® Н2) або О2 (у нейтральному чи лужному середовищі: О2 + 2Н2О + 4е ® 4ОН-).
Слід пам¢ятати, що технічні метали містять домішки інших металів і неметалів, що приводить до появи мікрогальванопар.
Необхідно звернути увагу, що електродні потенціали металів залежать від складу електроліту і рН середовища. Це необхідно враховувати на практиці для правильного прогнозування можливих корозійних руйнувань.
Для ілюстрації наведемо значення електродних потенціалів (В) деяких металів у різних середовищах (табл. 7):
Т а б л и ц я 7
Значення ∆Ео металів у різних середовищах
| Метал | E0 стандарт. | E Men+/Me0 в 0,1н. HCl | E Men+/Me0 в 3% NaCl |
| Al | -1,66 | -0,50 | -0,63 |
| Zn | -0,76 | -0,76 | -0,83 |
| Fe | -0,44 | -0,32 | -0,50 |
| Cu | -0,34 | -0,15 | -0,05 |
Отже, електрохімічний ряд напруг не можна вважати абсолютною характеристикою властивостей металів. Так, у морскій воді магній має потенціал -1,48 В (а не -2,38 В ), цинк -0,80 (а не -0,76 В), титан +0,15 В (а не -1,63 В)
Концентраційна корозія визначається градієнтом концентрації деполяризатора, наприклад, О2 (поверхневі шари води містять більше кисню, чим внутрішні), унаслідок чого на поверхні металу утворюється анодні і катодні ділянки:
Е = Е0 + 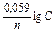 ). Корозії підлягає анодна ділянка:
). Корозії підлягає анодна ділянка:
| (-) А Fe | O2, H2O | Fe K (+). |
Електрокорозія – процес, що протікає під впливом постійного електричного струму від зовнішнього джерела (наприклад, під впливом блукаючих струмів: відгалуження струму від рейок електрифікованого транспорту й ін.).
Необхідно по підручниках ознайомитися з основними способами захисту металів від корозії, до числа яких відносять:
- створення раціональних конструкцій;
- обробку оточуючого дану конструкцію середовища (десульфуризацію бензину, гасу, мазуту, мастил); герметизацію приладів; застосування інгібіторів корозії;
- створення ізолюючих плівок на металах: низькотемпературних (змащення, лаки, фарби) або високотемпературних (хромування, нікелювання, цинкування, лудіння);
- хімічну обробку поверхні: оксидування, азотування, фосфатування, цементація;
- захист металів зовнішнім потенціалом: протекторна, електрозахист;
- створення і застосування нових сплавів, нових матеріалів.
12.2. Приклади розв’язку типових задач
Задача 1. Одна залізна деталь покрита алюмінієм, а інша – міддю. Яке покриття буде анодним, а яке катодним? Складіть схеми катодного й анодного процесів, що будуть протікати у вологому середовищі, якщо покриття в обох випадках порушено. Які продукти корозії утворюються в цих випадках?
Розв’язок. Порушення металевого покриття при наявності електроліту приводить до виникнення гальванопари, у якій покриття може виконувати роль анода (анодне покриття) чи роль катода (катодне покриття).
Оскільки електродний потенціал заліза менше, ніж у міді і більше, ніж у алюмінія, то покриття алюмінієм є анодним, а міддю – катодним.
При порушенні покриття виникнуть такі гальванопари:
| (-)Al | H2O, O2 | Fe(+) (-)Fe | H2O, O2 | Cu(+) |
A(-) Al – 3e ® Al3+ Е0 = - 0,74 В A(-) 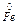 –2e ® Fe2+ Е0 =- 0,44 В
–2e ® Fe2+ Е0 =- 0,44 В
K(+) 2H2O + O2 + 4e ® 4OH-І0 = 0,40 В K(+) 2H2O + O2 + 4e ® 4OH-
------------------------------------ --------------------------------
4 Al + 6H2O + 3O2 = 4Al(OH)3 2 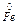 + 2H2O + O2 = 2Fe(OH)2
+ 2H2O + O2 = 2Fe(OH)2
Руйнується покриття Корозії підлягає залізо
Подальше окиснення йде відповідно рівнянню реакції:
2Fe(OH)2+ H2O + 1/2O2 ® 2Fe(OH)3,
і далі: Fe(OH)3 ® FeOOH + H2O
Задача 2. Залізні цистерни застосовують для транспортування концентрованої сірчаної кислоти. Якщо з цистерни вилити кислоту і залишити цистерну на повітрі відкритою, то вона порівняно швидко ржавіє. Чому? Складіть електронні рівняння для такого типу корозії.
Розв’язок.
Відомо, що пасивними ділянками (мікрокатодами) у вуглецевій сталі є зерна карбіду заліза Fe3C. Зерна a-заліза - мікроаноди. У даному випадку створюється гальванопара “метал – сполука металу”. Корозія в кислому середовищі (у концентрованій сірчаній кислоті залізо пасивується за рахунок утворення захисної оксидної плівки) буде відбуватися з водневою деполяризацією:
| (-) Fe | H2SO4 | Fe3C (+); |
А(-) 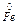 –2e ® Fe2+
–2e ® Fe2+
K(+) 2H+ + 2e ® 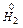
-------------------------
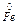 + 2H+ = Fe2+ +
+ 2H+ = Fe2+ + 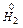
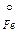 + 2H2SO4 = FeSO4 +
+ 2H2SO4 = FeSO4 + 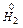 .
.
Задача 3. На підставі розрахунку DG реакції визначте ймовірність корозії у вологому повітрі, якого металу –олова чи свинцю – буде більше, вважаючи, що процес протікає за схемою:
2Ме + 2Н2О + О2 ® 2Ме(ОН)2 .
Розв’язок. Між величиною Е.Р.С. (DЕ) ОВР і ізобарно-ізотермічним потенціалом (DG) існує лінійна залежність. DG дорівнює максимальній роботі системи: - DG =Амакс; Амакс. визначається співвідношенням: Амакс. = n×F×DЕ, де n – число електронів, відданих відновником чи прийнятих окисником; F – стала Фарадея (96500 Кл/моль); DЕ – Е.Р.С. ОВР.
Неважко вивести залежність, що зв'язує зменшення ізобарно-ізотермічного потенціалу і Е.Р.С.:
DG = - n×F×DЕ.
Розрахуємо DG для процесу корозії олова: DGкор.(Sn) = -4×96500× (0,40-(-0,14)) = -208440 Дж або –208,4 кДж.
Проведемо аналогічний розрахунок для процесу корозії свинцю: DGкор.(Pb) = -4×96500× (0,40-(-0,13)) = -204580 Дж або –204,6 кДж. На підставі отриманих даних робимо висновок, що імовірність процесу корозії олова більше (більш негативне значення DG).
12.3. Задачі для самостійного рішення:
1. Які корозійні процеси будуть протікати, якщо магній знаходиться в контакті з міддю в нейтральному середовищі? Напишіть рівняння відповідних реакцій і укажіть вид корозії.
2. Залізо покрите оловом і знаходиться в сірчанокислому середовищі. Яке це покриття і які хімічні реакції будуть протікати при його порушенні?
3. Якщо до мідної пластинки, опущеної в кислоту, доторкнутися цинковою, то на міді починається бурхливе виділення водню. Дайте цьому пояснення, склавши рівняння реакцій, що протікають.
12.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви:
Сталеві пластинки, гранули цинку, мідні дротики, залізний цвях, шматочки фільтрувального і наждакового папера, розчини червоної кров'яної солі, калій дихромату, уротропіну, натрій хлориду, сірчаної кислоти, соляної кислоти, цинк і купрум сульфатів, спецреактив: 3%-ний натрій хлорид +фенолфталеїн,
Дослід 1. Типи корозійних руйнувань
Просочують смужку фільтрувального папера розчином червоної кров'яної солі К3[Fe(CN)6], і вологий папір прикладають до поверхні сталевої пластинки, попередньо зачищеної наждаковим папером.
Зверху кладуть 2-3 листа чистого папера і невеликий вантаж.
Через 15-20 хвилин знімають папір, відзначають характер його посиніння, записують рівняння корозійного руйнування заліза у вологому середовищі.
У висновках укажіть:
- Який тип корозійного руйнування ви знайшли: суцільна, плямами крапками (піттинг)?
- Навіщо смужку фільтрувального папера змочували розчином червоної кров'яної солі?








