Т е м а 12. Корозія металів і захист металів від корозії
12.1. Рекомендації до вивчення теоретичного матеріалу
Корозія металів – самовільний (спонтанний) процес руйнування металу (DG<0), який протікає під дією навколишнього середовища і проходить з виділенням тепла (DН < 0) та розсіюванням речовини (DS > 0). Корозію варто відрізняти від ерозії – механічного руйнування. Можливість протікання будь-якої хімічної реакції, включаючи корозію, визначається зміною енергії Гиббса DG. Тому стає зрозумілим, чому можлива корозія магнію і навіть міді в агресивному середовищі, в той час як золото корозії не піддається:
Mg + H2O(ж) + 1/2O2 ® Mg(OH)2 DG = -591,6 кДж;
Сu + H2O + 1/2O2 ® Сu(OH)2 DG = -119,5кДж;
Au + 3/2H2O + 3/4O2 ® Au(OH)3 = 65,6 кДж.
Корозію класифікують:
1. По геометричному характеру корозійних руйнувань:
суцільна; міжкристалітна; нерівномірна; пітинг; транскристалітна; структурно-виборча; плямами; підповерхнева.
2. По механізму протікання корозійних процесів:
а) хімічна: б) електрохімічна: в) особливі види:
- газова; - контактна; - біологічна;
- рідинна - концентраційна; - радіаційна;
- електрокорозія - ультразвукова
(під дією блукаючих струмів)
Слід чітко розрізняти механізм протікання хімічної і електрохімічної корозії.
Хімічна корозія – окисно-відновний процес руйнування металів під дією навколишнього середовища, що не супроводжується виникненням електричних корозійних струмів.
Газова корозія – найбільш розповсюджений вид хімічної корозії, що зумовлюється взаємодією металів з О2, SO2, H2S, CO, CO2 і іншими газами. Хімізм корозії під впливом кисню виражається рівнянням: nMe+ 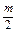 O2 ® MenOm., тобто по механізму протікання корозійних процесів – це звичайна гетерогенна окисно-відновна реакція.
O2 ® MenOm., тобто по механізму протікання корозійних процесів – це звичайна гетерогенна окисно-відновна реакція.
Швидкість окиснення металу і захисні властивості оксидних плівок залежать від цілісності (суцільності) оксидної плівки і швидкості дифузії окисника через плівку. Суцільність плівки і її захисні властивості визначається фактором Пілінга-Бедвордса (a), що визначається як a = 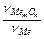 . Якщо a > 1, то така плівка має захисні властивості (докладно про це читайте в підручнику В.В.Фролова). Наприклад, для Mg α = 0,79. Отже, така оксидна плівка не захищає магній від корозії. Навпаки, для Al, Ni, Ti, Cr фактор Пілінга - Бедвордса має значення 1,31, 1,52, 1,76 і 2,02 відповідно. Такі плівки мають захисні властивості. На поверхні деяких металів (Cr, Ni) утворюються тонкі (до 40 мкм), непомітні, але щільні оксидні плівки.
. Якщо a > 1, то така плівка має захисні властивості (докладно про це читайте в підручнику В.В.Фролова). Наприклад, для Mg α = 0,79. Отже, така оксидна плівка не захищає магній від корозії. Навпаки, для Al, Ni, Ti, Cr фактор Пілінга - Бедвордса має значення 1,31, 1,52, 1,76 і 2,02 відповідно. Такі плівки мають захисні властивості. На поверхні деяких металів (Cr, Ni) утворюються тонкі (до 40 мкм), непомітні, але щільні оксидні плівки.








