Дослід 1. Принцип дії гальванічних елементів. Визначення Е.Р.С.
а) елемент Вольта
Обидва мікростаканчики заповнюють 1 н. розчином сірчаної кислоти і встановлюють їх у поглиблення підставки. У стаканчики занурюють електроди: цинковий (анод) і мідний (катод). З'єднують стаканчики електролітичним ключем, заповненим насиченим розчином хлориду калію в суміші з агар-агаром. Спостерігають відхилення стрілки гальванометра, що вказує на виникнення електричного струму внаслідок різних значень електродних потенціалів цинку і міді.
Складають схему гальванічного елемента. Записують рівняння процесів, що протікають при роботі цих гальванічних елементів. Записують величини електродних потенціалів, прийнявши умовно, що концентрація іонів дорівнює їхньої активності. Розраховують Е.Р.С. (DЕ) елемента і порівнюють її з експериментальним значенням. Розраховують енергію Гіббса ( D G = - n × F × D Е).
б) елемент Даніеля-Якобі
Збирають аналогічно елементу Вольта, з тією лише різницею, що цинковий електрод занурюють у 1н. розчин цинк сульфату, а мідний – у 1н. розчин купрум сульфату. Виконують зазначені вище в досліді 1а завдання.
У висновках укажіть:
- Чим відрізняється принцип роботи цих гальванічних елементів?
- У чому причина розбіжності значень Е.Р.С., розрахованих теоретично і виявлених в експерименті?
- Чому з часом змінюються показання вольтметра?
Дослід 2. Вплив концентрації розчинів електролітів на Е.Р.С. гальванічного елемента
Збирають мідно-цинковий елемент Даніеля-Якобі. Заливають у мікростаканчики розчини сульфату міді і сульфату цинку різної концентрації (див. таблицю), визначають значення Е.Р.С. за показниками вольтметра.
Розраховують рівноважні потенціали електродів по спрощеній формулі Нернста, прийнявши умовно, що концентрації іонів дорівнюють активності. Розраховують Е.Р.С. і порівнюють її з обмірюваною.
Результати досліду оформляють у виді таблиці:
| № п/п | Концентрація розчинів, моль/л | Рівноважні потенціали електродів, В | Е.Р.С.розр, В | Е.Р.С.експ., В | ||
| 1 | СuSО4 | ZnSO4 | 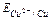
| 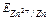
| ||
| 2 | 1 | 1 | ||||
| 3 | 0,1 | 0,01 | ||||
| 4 | 0,01 | 0,01 | ||||
У висновках укажіть:
- Як впливає зміна концентрації електроліту на величину рівноважного потенціалу і Е.Р.С.?
- Чому розраховані значення Е.Р.С. відрізняються від експериментальних значень?
11.5. Список рекомендованої дітератури
1. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.263-284; 2004. – С. 273 – 289.
2. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 170-183.
3. Курс общей химии / Под ред. Коровина А.В. – М.: Высш. шк., 1985. – С.190-206.
4. Фролов В.В. Химия. – М.: Высш. шк., 1986. – С.227-239.
5. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С.222-225 (2001. – С. 240 – 247).
6. Кириченко В.І. Загальна хімія: Навч. посіб. – К.: Вища шк., 2005. – С. 311-323.








