Дослід 5. Окисно-відновна подвійність гідроген пероксиду
У дві пробірки наливають по 2-3 мл розчину Н2О2 і по 2-3 краплі 2 н. розчину сірчаної кислоти.
В одну пробірку доливають 2-3 мл перманганату калію, а в другу – такий же об¢єм розчину йодиду калію. Відзначають спостереження. Записують рівняння реакцій, використовуючи метод напівреакцій.
У висновках укажіть: окисником чи відновником був гідроген пероксид в цих реакціях?
10.5. Список рекомендованої літератури
1. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.255-266.
2. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 161-182.
3. Курс общей химии / Под ред. Коровина А.В. – М.: Высш. шк., 1985. – С.185-190.
4. Фролов В.В. Химия. – М.: Высш. шк., 1986. – С.225-229.
5. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С.214-222 (2001. – С. 234 – 244).
6. Кириченко В.І. Загальна хімія: Навч. посіб.- К.: Вища шк., 2005. – С. 285-310.
М о д у л ь 4. ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ
Електрохімія вивчає велику область фізико-хімічних процесів, що умовно можна розділити на дві групи:
1) явища, пов'язані з виникненням різниці потенціалів і одержанням електричної енергії за рахунок окисно-відновної реакції (хімічні джерела струму);
2) здійснення окисно-відновної реакції й одержання речовин за рахунок витрати електричної енергії (електроліз).
До першої групи явищ слід віднести й електрохімічну корозію, оскільки механізм виникнення корозійних струмів має ту ж природу, що і механізм одержання електричного струму в гальванічних елементах.
Ці теми найбільше глибоко і повно розглянуто в підручниках В.В.Фролова, Кириченко В.І., Коровіна А.В. Крім того, по окремим питанням електрохімії надрукована численна додаткова література. У курсі загальної хімії для нехімічних спеціальностей зазначені явища розглядаються при вивченні наступних тем: «Гальванічні елементи», «Корозія металів і захист від корозії», «Електроліз».
Т е м а 11. Гальванічні елементи
11.1. Рекомендації до вивчення теоретичного матеріалу
Гальванічні елементи (ГЕ) – це системи або пристрії, в яких енергія гетерогенних окисно-відновних реакцій перетворюється в енергію електричну. В основі роботи всіх ГЕ лежить явище виникнення потенціалу на межі метал – електроліт. Варто уважно вивчити по підручнику особливості процесу виникнення електродного потенціалу, звернувши увагу на фактори, що впливають на його величину (температура, концентрація розчину електроліту, матеріал електрода ін.). Цілком зрозуміло, що різні по природі метали мають різну електролітичну пружність розчинення (тобто здатність посилати свої іони в розчин). Звідси випливає, що за однакових умов величина електродних потенціалів різних металів буде різна. Вперше залежність величини електродного потенціалу (Е) від різних факторів визначено В.Нернстом (1888 р.):
Е = 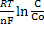 ,
,
де R- універсальна газова стала; Т - абсолютна температура (К); n - число електронів у реакції окиснення металу; F – стала Фарадея; с і сo - концентрація іона метала в глибині розчину і на поверхні електроду. Концентрацію сo неможливо визначити точно; звідси випливає, що абсолютне значення електродного потенціалу визначити неможливо. На практиці визначають різницю потенціалів, тобто потенціал даного електрода відносно іншого електрода, потенціал якого прийнятий за стандарт. Найчастіше таким стандартним електродом виступає нормальний (стандартний) водневий електрод, потенціал якого прийнятий за 0 В. У цьому випадку величину електродних потенціалів (Е) можна обчислити по рівнянню Нернста: Е = Е0 + 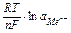 або в спрощеному виді Е = Е0 +
або в спрощеному виді Е = Е0 + 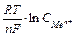 , (де Е0 – стандартний електродний потенціал металу – табличні дані; R – універсальна газова стала; Т – абсолютна температура (К), n – число електронів у реакції окиснення металу, F – стала Фарадея; а
, (де Е0 – стандартний електродний потенціал металу – табличні дані; R – універсальна газова стала; Т – абсолютна температура (К), n – число електронів у реакції окиснення металу, F – стала Фарадея; а 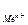 - активність металу: а
- активність металу: а 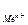 = f × С
= f × С 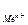 (f – коефіцієнт активності)).
(f – коефіцієнт активності)).
Якщо прийняти, що температура, при якій визначається потенціал, дорівнює 250С (298 К), то після невеликих перетворень маємо з невеликою погрішністю зручну для більшості розрахунків формулу: Е = Е0 + 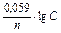 . Тут Е0 – стандартний електродний потенціал даного електрода відносно нормального водневого електрода за умовою, що концентрація (точніше, активність а) іонів металу дорівнює 1 моль/л.
. Тут Е0 – стандартний електродний потенціал даного електрода відносно нормального водневого електрода за умовою, що концентрація (точніше, активність а) іонів металу дорівнює 1 моль/л.
Гальванічні елементи прийнято позначати у виді формул. Наприклад, формула елемента Даніеля-Якобі:
| Zn Анод (-) | Zn2+(с) 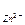
| Cu2+(с) 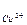
| Cu (+) катод |
На аноді протікають процеси окиснення (віддачі електронів), на катоді – відновлення (прийняття електронів). При цьому електрони переміщуються по зовнішньому ланцюгу, виконуючи корисну роботу. Таким чином, при роботі ГЕ процеси окиснення і відновлення просторово роз'єднані. Е.Р.С. гальванічного елемента розраховується як різниця потенціалу катода й анода, кожному з який відповідає конкретна напівреакція:
Е.Р.С. = Ек – Еа.
Теоретично будь-яка окисно-відновна реакція (ОВР) може служити джерелом струму, тому для будь-якої ОВР можна розрахувати Е.Р.С. за формулою: Е.Р.С. = DЕ = Еок-ка – Ев-ка.
Якщо, відповідно до розрахунків, Е.Р.С.>0, то ГЕ буде працювати, а окисно-відновна реакція в даних умовах можлива.
Варто ознайомитися по підручнику з різновидами ГЕ (Вольта, Даніеля-Якобі, Грене, Лекланше, концентраційними, повітряно-металевими ГЕ та ін.), а також з будовою і принципом дії акумуляторів.
Нижче наведені формули ГЕ (хімічних джерел струму), які використовуються найчастіше:
Т а б л и ц я 6
Хімічні джерела струму
№
 1
2
3
4
5
6
7
8
9
1
2
3
1
2
3
4
5
6
7
8
9
1
2
3
| Гальванічний елемент : Елемент Лекланше Елемент Грене “Гудзикового типу” Повітряно-металевий Літієвий Мангано-магнієвий Мідно-цинковий Свинцево-цинковий свинцево-кадмієвий Акумулятори: Кислотний Лужний (Cd/Ni) Лужний (Fe/Ni) | Формула ГЕ : (-) Zn |NH4Cl|| MnO2 |(C) (+) Zn|H2SO4|| K2Cr2O7| (C) Zn|електроліт||Ag2O(або AgО)|катод Me(Al,Zn)|електроліт||O2| катод Li|електроліт, розчинник| катод Mg|MgBr2||MnO2|(C) Zn|NaOH||CuO|Cu Zn|H2SO4||PbO2|Pb Cd|H2SO4|| PbO2| Pb (-) Pb| H2SO4|| PbO2 |(Pb) (+) Cd|KOH||NiO(OH)|Ni Fe| KOH||NiO(OH)|Ni | Е.Р.С., В 1,5 ~2,0 1,35 ~2,6-2,5 ~2,5-3,5 2,0 0,6-1,0 2,5 2,2 1,95-2,15 1,30-1,34 1,37-1,41 |
Зазначимо також, що на практиці реальний електродний потенціал ΔЕ (Е.Р.С) завжди нижче, ніж розрахований згідно з теорією. Падіння потенціалу обумовлене побічними процесами, які відбуваються при роботі хімічних джерел струму: поляризацією, наявністю електроопору, втрати електрики в зоні контактів і інш.:
ΔЕпракт. = ΔЕтеор. - ІR - ΔЕполяр. - ΔЕконт.
11.2. Приклади розв ¢ язування типових задач
Задача1. Запропонуйте два ГЕ, в одному з яких цинк є анодом, а у другому - катодом. Напишіть рівняння реакцій, що відбуваються на електродах при роботі цих елементів, розрахуйте Е.Р.С. і ΔG за стандартних умов.
Розв`язок . Перший ГЕ: анод (-) Zn|Zn2+||Cu2+|Cu(+)катод .
На аноді (-): Zn0 - 2e → Zn2+; на катоді (+): Cu2+ + 2e → Cu0 .
E.P.C.(ΔE ) = Eк – Eа = 0,34 - (-0,76) = 1,10 B .
ΔG = -nF·ΔE = -2·96500·1,10 = 212300 Дж/моль = 212,3 кДж/моль .
Другий ГЕ: анод (-) Mg|Mg2+||Zn2+|Zn(+) катод .
На аноді (-): Mg0 - 2e → Mg2+ ; на катоді (+): Zn2+ + 2e → Zn0 .
Е.Р.С. (ΔЕ) = Eк – Eа = -0,76 - (-2,38) = 1,62 В.
ΔG = - nF·ΔE = -2·96500·1,62 = 321660 Дж/моль = 312,66 кДж/моль .
Задача 2. Складіть схему гальванічного елемента, у якому електродами є залізо і мідь, занурені в розчини з молярною концентрацією іонів відповідно 1 і 0,1 моль/л відповідно; розрахуйте його Е.Р.С..
Роз’вязок. Схема гальванічного елемента має вид:
| (-)Fe | Fe2+(1 М) | Cu2+(0,1 М) | Cu (+) |
Вертикальна риса позначає поверхню розділу між електродами (металами) і розчином, а дві риси – межу, розподілу рідких фаз. Залізо має менший потенціал (– 0,44 В) (у порівнянні з міддю) і є анодом, на якому протікає процес окиснення :
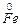 – 2e ® Fe2+.
– 2e ® Fe2+.
Мідь, електродний потенціал якої + 0,34 В, є катодом, тобто електродом, на якому протікає відновний процес:
Сu2+ + 2e ® 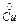 .
.
Рівняння окисно-відновної реакції, що характеризує роботу даного гальванічного елемента, має вид:
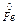 + Сu2+ ® Fe2+ +
+ Сu2+ ® Fe2+ + 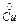 .
.
Е.Р.С. гальванічного елемента визначаємо як різницю електродних потенціалів катода й анода:
Е.Р.С. = Ек – Еа E 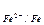 = -0,44 -
= -0,44 - 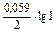 = -0,44 В;
= -0,44 В;
Е 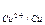 = 0,34 -
= 0,34 - 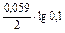 = 0,31 В. Е.Р.С. = 0,31 – (-0,44) = 0,75 В.
= 0,31 В. Е.Р.С. = 0,31 – (-0,44) = 0,75 В.
Задача 3. Який гальванічний елемент називається концентраційним? Складіть схему, напишіть електронні рівняння електродних процесів і обчисліть Е.Р.С. гальванічного елемента, що складається зі срібних електродів, занурених відповідно в 0,01 М и 0,1 М розчини аргентум нітрату.
Розв’язок. Гальванічний елемент може бути складений не тільки з різних, але і з однакових металевих електродів, занурених у розчини солей цього металу, що розрізняються тільки концентрацією – концентраційні гальванічні елементи.
Стандартний електродний потенціал Е0 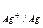 = 0,80 В. Позначимо потенціал першого електрода Е1, а другого – Е2, тоді: Е1 = 0,80 + 0,059×lg0,01 = 0,68 В; Е2 = 0,80 + 0,059×lg0,1 = 0,74 В.
= 0,80 В. Позначимо потенціал першого електрода Е1, а другого – Е2, тоді: Е1 = 0,80 + 0,059×lg0,01 = 0,68 В; Е2 = 0,80 + 0,059×lg0,1 = 0,74 В.
Оскільки Е1<Е2, то перший електрод буде служити негативним полюсом елемента (анодом), і електрони будуть переміщатися від нього до другого електрода (катода):
| (-) Ag | AgNO3 (0,01 M) | AgNO (0,1М) | Ag (+) |
Анодний процес (окиснення): 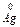 – e ® Ag+
– e ® Ag+
Катодний процес (відновлення): Ag+ + е ® 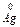 . Сумарно :
. Сумарно : 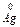 + Ag+=
+ Ag+= 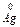 + Ag+
+ Ag+
1.3. Задачі для самостійного рішення: 658, 660, 661
11.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: вольтметр, підставка до приладу для гальванічного елемента, електролітичний місток, мікростаканчики, мідний і цинковий електроди, розчини: цинк сульфату, купрум сульфату: 0,01н.; 0,1 н.; 1н., сульфатної (сірчаної) кислоти 1н.








