10.2. Приклади рішення типових задач
Задача 1. Складіть рівняння розчинення дисульфіду заліза (2+) у концентрованій нітратній (азотній) кислоті, використовуючи метод електронного балансу.
Розв’язок.
- Нітроген, що має максимальний ступінь окиснення в нітратній кислоті +5, є окисником. Приєднуючи електрон, він зменшує ступінь окиснення до +4 (NO2).
- Залізо (2+) і сірка (формальна ступінь окиснення -1), знаходячись у проміжних ступенях окиснення, є відновниками. Віддаючи електрони, вони підвищують ступені окиснення до +3 і +6 відповідно, утворюючи іон заліза (3+) і сульфатну (сірчану) кислоту.
- З огляду на те, що вся молекула FeS2 віддає електрони, необхідно в електронній схемі враховувати молярне співвідношення заліза і сірки, тобто 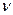 Fe :
Fe : 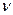 S = 1:2.
S = 1:2.
| - Складаємо електронні рівняння процесів відновлення й окислення: | 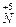 + e ® + e ® 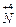 15 15
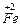 - e ® - e ® 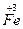 2
2 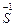 - 14 e ® 2 - 14 e ® 2 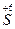
|
- При складанні молекулярного рівняння враховуємо, що азотна кислота, крім окислюючих властивостей, виявляє властивості кислоти, утворюючи сіль Fe(NO3)3:
FeS2 + 18 HNO3 ® Fe(NO3)3 + 2 H2SO4 + 15 NO2 + 7 H2O.
- Зрівнюючи число атомів нітрогену, необхідно пам'ятати, що в правій частині рівняння нітроген міститься в двох речовинах: Fe(NO3)3 і NO2. Коефіцієнт 15 ставимо перед NO2, тому що саме NO2 – продукт відновлення нітратної кислоти. Перед формулою HNO3 у лівій частині ставимо коефіцієнт 18 (з урахуванням трьох атомів нітрогену у формулі Fe(NO3)3).
Задача 2. Запишіть рівняння реакції взаємодії ферум(2+) сульфату з калій біхроматом в сірчанокислому середовищі, використовуючи метод напівреакцій, і обчисліть ЕРС реакції.
Розв’язок. Виконуємо послідовно наступні дії. Встановлюємо, що в наведеній реакції К2Сr2O7 – окисник; FeSO4 – відновник; Н2SO4 – середовище. Записуємо рівняння відновлення в іонно-молекулярному виді: Сr2O72- + 14H+ + 6e ® 2Cr3+ + 7H2O, з огляду на те, що у водному розчині можуть брати участь у реакції Н+,ОН-, Н2О.
У даній реакції для зв'язування семи атомів оксигену, що входять до складу Сr2O72-, необхідні 14 іонів H+, і тоді утворяться сім молекул H2O. Перевіряємо матеріальний баланс по оксигену і, нарешті, додаємо шість електронів, щоб сумарний заряд вихідних речовин і продуктів був однаковий.
Записуємо рівняння окиснення: Fe2+ -e ® Fe3+.
Множимо кожен член рівняння окиснення на шість (кількість відданих і прийнятих електронів повинна бути однаковою) і підсумовуємо обидва рівняння:
Сr2O72- + 14H+ + 6e ® 2Cr3+ + 7H2O |1
Fe2+ -e ® Fe3+ |6
Сr2O72- + 14H+ + 6 Fe2+ = 2Cr3+ + 7H2O +6 Fe3+
У результаті одержуємо іонно-молекулярне рівняння ОВР.
Записуємо молекулярне рівняння, з огляду на те, що для зв'язування катіонів варто використовувати аніон сульфатної кислоти:
К2Сr2O7 + 6FeSO4 + 7H2SO4 ® Сr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O.
Розраховуємо Е.Р.С.: = Е0ок - Е0відн = 1,333 – 0,771 = 0,562 (В).
Задача 3. Запишіть реакції окиснення фосфіну до фосфат-аніона в кислому, нейтральному і лужному середовищах.
Розв’язок.
- нейтральне і кисле середовище: РН3 + 4Н2О – 8е ® Н3РО4 + 8Н+
- лужне середовище: РН3 + 11ОН- -8е ® РО43- + 7Н2О.
10.3. Задачі для самостійного рішення: 624, 625, 626, 640
10.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: штативи з пробірками, розчини гідроксиду натрію, ферум(2+) сульфату, калій дихромату, сірчаної кислоти, калій перманганату, сульфіту натрію, сульфіду натрію, йодиду калію, нітриту натрію, хлориду олова (2+), кристалічний ферум сульфат .








