Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
9.1. Рекомендації до вивчення теоретичного матеріалу
Властивості розчину завжди відрізняються від властивостей вихідних компонентів, що пов’язано, по-перше, з характером взаємодії між компонентами, а по-друге, зі зменшенням концентрації кожної з речовин при розподілі в ній іншої речовини. Властивості, які залежать лише від концентрації часток у розчині, називаються колігативними. У задачнику М.Л.Глінки наведені приклади і охарактеризовані деякі з колігативних властивостей: а) зниження тиску пари розчинів у порівнянні з тиском пари чистого розчинника (перший закон Ф.М.Рауля, 1887 р.); б) підвищення температури кипіння (Δtкип. ) або зниження температури замерзання (Δtзам. ) при утворенні розчинів (другий закон Ф.М.Рауля); в) закон осмотичного тиску (Я.Вант-Гофф, 1887 р.).
Варто детально ознайомитися з теорією електолітичної дисоціації, основні положення якої для водних розчинів уперше були сформульовані С.Арреніусом (1887 р.):
- при розчинені у воді солей, кислот і основ відбувається їх розпад (дисоціація) з утворенням електрично заряджених частинок- іонів, між якими діють електростатичні сили притягування і відштовхування;
- у відсутності електричного струму іони рухаються хаотично, а при проходженні постійного струму вони набувають направленого руху: до катоду (-) рухаються позитивно заряджені іони (катіони), а до аноду (+) – негативно заряджені іони (аніони).
Положення теорії С.Арреніуса були значно доповнені і розширені при детальному вивчені властивостей неводних систем. Були встановлені фактори, які суттєво впливають на процес дисоціації; насамперед, це - природа розчинника і речовин, що розчинюються. Іоногенні речовини з ковалентним типом звязку (НСl, NН3, НВr) при розчинені у полярних розчинниках (вода, спирти, диметилформамід і т. інш.) утворюють розчини, що проводять електричний струм, тобто виявляють властивості електролітів, наприклад:
NН3(газ) + (m+n)Н2О ↔ {NН4ОН(розчин)}↔ NН4+·mH2O + ОН-·nH2O
НСl(газ) + (m+n)Н2О ↔{розчин НСl} ↔ Н+·mН2О +Сl-·nН2O
Але їх розчини в неполярних розчинниках (бензол, гексан, хлороформ) не проводять електричний струм, тобто, є неелектролітами
Іонофорні речовини з іонним типом звязку (NаСl, СuСl2, NаNО3) утворюють розчини, що проводять електричний струм. В свою чергу, розчинники розділяють на неіонізуючі, іонізуючі (такі, що викликають іонізацію речовин, проте не її дисоціацію) і дисоціюючі (тобто, сприяють не тільки іонізації, але й дисоціації речовини на іони).
Кількісно здатність електроліту дисоціювати (розпадатися) на іони оцінюють за допомогою ступеня дисоціації α - відношення молярної концентрації продисоційованих молекул до вихідної концентрації цих молекул. Якщо в 0,1н. розчині a > 30% електроліт вважається сильним, якщо a < 10% - електроліт слабкий, якщо 10%< a <30% - електроліт середньої сили. Ступінь дисоціації при розведенні розчину зростає, тобто, залежить від концентрації електроліта. Сильні електроліти у розчинах практично повністю дисоціюють на іони, їх істинний ступінь дисоціації дорівнює одиниці. Але внаслідок електростатичного притягування катіонів і аніонів утворюються “іонні пари” і більш складні іонні асоціати, що знижує концентрацію вільних іонів. Властивості розчинів сильних електролітів внаслідок цього змінюються так, нібито зменшується ступінь дисоціації. Для урахування цих змін введено поняття ”уявного ступеня дисоціації”. В більшості випадків αуявн. має значення у межах від 0,7 до 0,95 . До сильних електролітів відносяться практично всі солі, крім деяких внутрішньокомплексних, гідроксиди лужних і лужноземельних елементів, кислоти – соляна, сірчана, азотна, бромоводнева, йодоводнева, хлорна. До слабких – NH4OH, оцтова, азотиста кислоти й ін.
Більш зручна для характеристики сили електроліту Кд – константа електролітичної дисоціації, що не залежить від концентрації. Вона являє собою константу рівноваги, що описує процес дисоціації:
АВ2 ↔ А+ + 2В- Кд = 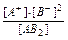 .
.
При розрахунках рівноваг у розведених розчинах слабких бінарних електролітів (a < 0,1) необхідно застосовувати закон розведення Оствальда: Кд = 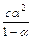 . Якщо a << 0,1, то 1-a » 1 і можна вважати (з невеликою погрішністю), що Кд = С×a2, де С – молярна концентрація. Кд для слабких електролітів (водні розчини) наведені в табл. 6 задачника М.Л. Глінки. Для небінарних (полінарних) електролітів процес дисоціації здійснюється ступінчасто, причому кожна зі ступіней описується своєю константою. У цьому випадку К1>K2>K3 і т.д., а загальна константа К = К1×К2×К3.
. Якщо a << 0,1, то 1-a » 1 і можна вважати (з невеликою погрішністю), що Кд = С×a2, де С – молярна концентрація. Кд для слабких електролітів (водні розчини) наведені в табл. 6 задачника М.Л. Глінки. Для небінарних (полінарних) електролітів процес дисоціації здійснюється ступінчасто, причому кожна зі ступіней описується своєю константою. У цьому випадку К1>K2>K3 і т.д., а загальна константа К = К1×К2×К3.
Необхідно порівняти колігативні властивості розчинів електролітів і неелектролітів, відзначивши їхні відмінності. Наприклад, у законах Рауля для електролітів введено поправочний коефіцієнт і (ізотонічний коефіцієнт Я. Вант-Гоффа), пов'язаний зі ступенем дисоціації a співвідношенням a = 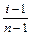 , де n – число часток, на які дисоціює електроліт. Таким чином, використовуючи невеликий набір величин (Кд, a, і, С) можна проводити важливі практичні розрахунки (див. типові задачі).
, де n – число часток, на які дисоціює електроліт. Таким чином, використовуючи невеликий набір величин (Кд, a, і, С) можна проводити важливі практичні розрахунки (див. типові задачі).
Варто особливу увагу приділити розділу «Водневий показник. рН», тому що ці поняття часто можуть зустрітися у виробничій діяльності майбутнього фахівця. Цей матеріал коротко викладений у задачнику М.Л. Глінки. Відзначимо, що вода, що є слабким електролітом, рівноважно дисоціює на протони і гідроксильні групи. Ця рівновага описується іонним добутком води: Кw = [H+][OH-] = 10-14. У чистій воді [H+] =[OH-] = 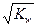 = 10-7 моль/л, у кислому середовищі: [H+] > 10-7 ([OH-]<10-7), а в лужному: [H+]<10-7 ([OH-]>10-7).
= 10-7 моль/л, у кислому середовищі: [H+] > 10-7 ([OH-]<10-7), а в лужному: [H+]<10-7 ([OH-]>10-7).
Для характеристики кислотності середовища прийнято використовувати логарифм концентрації іонів гідрогену зі зворотним знаком: рН = -lg[H+]. Виходячи з Кw: -lg[H+] - lg[ОH-] = 14; рН + рОН = 14. Тоді в кислому середовищі рН<7, а в лужному рН>7. Вважаючи, що вода є слабким електролітом, внеском її дисоціації в значення рН можна зневажити. Розрахунок рН розчинів слабких і сильних електролітів відрізняється істотно (див. додаток). Сильні електроліти (кислоти, луги) практично цілком дисоційовані у водних розчинах. Для помірно і сильно розведених розчинів можна вважати, що [H+] = Cк-ти, а [OH-] = Cлуги. Тому, з невеликою погрішністю можна вважати, що рН » -lgCк-ти, і рОН » -lgСлуги. Для слабких електролітів [H+] = C×a (для кислот) або [ОН-] = C×a (для основ), тобто необхідно враховувати ступінь дисоціації. Якщо за умовою задачі величина a не дана, то її знаходять із закону розведення Оствальда: Кд = 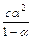 . Оскільки a =
. Оскільки a = 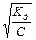 , то [H+] = С·
, то [H+] = С· 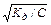 =
= 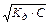 . Майте на увазі, що якщо a > 0,1, розрахунок варто робити, вирішуючи квадратні рівняння: Сa2 + Сa - С = 0 і [H+]2 + K[H+] – KC = 0.
. Майте на увазі, що якщо a > 0,1, розрахунок варто робити, вирішуючи квадратні рівняння: Сa2 + Сa - С = 0 і [H+]2 + K[H+] – KC = 0.
На практиці часто виникає необхідність підтримувати рН в певних межах. Розчини, які здатні підтримувати практично стале значення рН при додаванні до них певної кількості кислоти чи лугу, називаються буферними розчинами, або буферами. Механізм буферної дії розглянуто в багатьох підручниках. Зазначимо лише, що для розрахунків рН буферних розчинів користуються формулами:
- для суміші розчинів слабкої кислоти і солі, утворенної цією кислотою і сильною основою (наприклад, СН3СООН + СН3СООNа, ацетатний буфер):
рН = рКкислоти - lg(Скислоти/Ссолі);
- - для суміші слабкої основи і солі цієї основиі сильної кислоти(наприклад,NН4ОН + NН4Сl, амонійний буфер):
pН = 14 – рКоснови + (Соснови/Ссолі).
Ґрунтуючись на теорії електролітичної дисоціації, можна стверджувати, що рівновага в реакціях зміщається в тому напрямку, при якому відбувається більш повне зв'язування іонів в молекули. Визначаючи напрямок реакції між електролітами в розчині, необхідно враховувати можливість утворення:
- малорозчинної або малодисоційованої сполуки;
- газоподібного продукту.
Тому при виводячи молекулярно-іонні рівняння реакцій варто записувати малорозчинні, малодисоційовані і газоподібні продукти у виді молекул, а всі інші – у виді іонів.
Окремим випадком обмінної реакції в розчині є гідроліз. Гідроліз солей, тобто їх обмінна взаємодія з водою, відбувається тільки в тому випадку, якщо іони солі здатні утворювати з іонами води малодисоційовані сполуки. Це можливо в тих випадках, коли або катіон, або аніон солі є іоном слабкої кислоти або основи. Процес гідролізу докладно розглядався в шкільному курсі хімії. Нагадаємо, що гідролізу піддаються три типи солей:
- сіль утворена сильною основою і слабкою кислотою:
Na2CO3+H2O®NaHCO3+NaOH; CO32-+ H2O®HCO3-+OH-; (pН>7);
- сіль утворена слабкою основою і сильною кислотою:
2ZnSO4+ H2O®(ZnOH)2SO4+H2SO4; 2Zn2++ H2O®2ZnOH++H+ (pН<7);
- сіль утворена слабкою кислотою і слабкою основою:
(NH4)2CO3+H2O®NH4HCO3+NH3 ×H2O; NH4++CO32-+H2O®HCO3-+NH3 H2O (рН ≈ 7) .
Константа дисоціації іона HCO3- менше, ніж NH3×H2O, отже в розчині створюється слаболужне середовище. Варто врахувати, що майже завжди при гідролізі найслабкішим електролітом є вода, тому рівновага зміщена вліво. Значно рідше рівновага зміщена вправо, і вкрай рідко солі гідролізуються цілком. Останній випадок можливий, якщо речовини, що утворюються при гідролізі, не можуть вступити в реакцію нейтралізації: (осад+газ; осад+осад; газ+осад; газ+газ).
Формула для розрахунків рН водних розчинів сильних і слабких кислот і основ, солей, що гідролізуються, а також буферних розчинів зведені у таблицю (див. додаток).
9.2. Приклади розв ¢ язування типових задач
Задача 1. Температура кипіння 3,2% розчину ВаСl2 100,2080С. Обчисліть ступінь дисоціації солі в розчині.
Розв’язок. Використовуючи наслідок із закону Рауля, запишемо:
Dtкип = 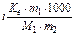 , звідки знаходимо: і =
, звідки знаходимо: і = 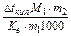 . Після підстановки даних умови задачі маємо:
. Після підстановки даних умови задачі маємо:
і = 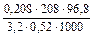 =2,52, де m1=3,2 г, а m2 = 96,8 г (виходячи з 100 г розчину). Отже: і = 1 + a(n-1);
=2,52, де m1=3,2 г, а m2 = 96,8 г (виходячи з 100 г розчину). Отже: і = 1 + a(n-1);
a = 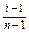 , де n =3; a =
, де n =3; a = 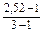 = 0,76
= 0,76
Задача 2. Обчисліть рН 0,1 М розчину НСl, якщо ступінь дисоціації a = 90%.
Розв’язок. Соляна (хлоридна) кислота - сильний бінарний електроліт.
НСl ↔ Н++ Сl- . Отже, [H+] = CHCl×a = 0,1×0,9 = 0,09 (моль/л); рН = -lg[H+] = -lg0,09 = 1,05.
Задача 3. Обчисліть концентрацію іонів Н+ і рН 0,02 М розчину амоніаку, якщо Кд амоніаку дорівнює 1,8×10-5.
Розв’язок. У водному розчині амоніаку існує рівновага:
NH3 + H2O ↔ NH+ + OH-, Кд має вид: Кд = 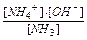 . Амоніак є слабкою основою, тому [OH-] =
. Амоніак є слабкою основою, тому [OH-] = 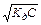 . У водних розчинах добуток концентрацій іонів Н+ і ОН- сталий (при постійній температурі).
. У водних розчинах добуток концентрацій іонів Н+ і ОН- сталий (при постійній температурі).
[H+]×[OH-] = Kw Þ [H+] = 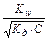 Þ [H+] = 1,67×10-11 моль/л.
Þ [H+] = 1,67×10-11 моль/л.
рН = -lg 1,67×10-11 = 11 - lg1,67 = 11 - 0,2 = 10,8.
9.3. Задачі для самостійного рішення: № 516, 544, 586
9.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: рН-метр, скляні палички, безрозмірні піпетки (скляні трубочки), індикатори: лакмус, універсальний індикатор, розчини барій хлориду, аргентум нітрату, алюміній хлориду, калій карбонату, калій сульфату, кислот: соляної, сірчаної, азотної, ортофосфорної, оцтової; натрій і амоній гідроксидів.








