Дослід 3. Комплексонометричне визначення жорсткості води
У практиці технічного лабораторного аналізу води найчастіше використовують комплексонометричний метод, застосований на титруванні зразка води комплексоном ІІІ (двонатрієва сіль етилендіамінтетраоцтової кислоти, або трилон Б) (ЕДТА, або Na2H2Y).
Комплексон ІІІ утворює з багатьма катіонами, у тому числі, і з катіонами лужноземельних металів (Ca2+, Mg2+, Ba2+), стійкі розчинні у воді внутрішньокомплексні солі (за рахунок заміщення атомів Н у групах СООН і утворення додаткових координаційних зв’язків з обома N-атомами). Алаліз води на вміст іонів Ca2+ і Mg2+ проводять у лужному середовищі, використовуючи різні індикатори: для визначення суми іонів Ca2+ і Mg2+ - хромоген чорний спеціальний ЕТ-00 (зарубіжна назва – еріохром чорний Т); для визначення іонів Ca2+ - мурексид (амонійна сіль пурпурної кислоти). У обох випадках при титруванні в еквівалентній точці винно-червоний колір розчину змінюється на синій.
Хід роботи :
а) Визначення загальної жорсткості води (суми [ Ca2+] і [ Mg2+]) .В колбу для титрування відбирають 100 мл досліджуваної води, додають 5 мл амонійної буферної суміші (рН≈10) і 20-30 мг (на кінчику шпателя) сухої суміші індикатора хромогену чорного з NaCl (1:100) до появи чіткого, але не дуже інтенсивного винно-червоного кольору розчину. Титрують воду 0,05 н. робочим розчином комплексна ІІІ до переходу винно-червоного кольору в синій (в кінці титрування розчин комплексна треба додавати краплинами до змінення червоного відтінку розчина). Дослід повторюють 203 рази. Загальну жорсткість води (в мекв Ca2+ і Mg2+ на 1 л) розраховують за формулою:
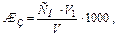
де СН – нормальність розчину комплексна ІІІ; V1 – об’єм робочого розчину комплексна, витраченого на титрування, мл; V - об’єм води, взятий для аналізу, мл.
б) Визначення вмісту іонів Ca 2+ і Mg 2+ у воді.Відбирають для аналізу 100 мл води, додають 20 мл 2н. розчину NaOH, декілька кристалів мурексиду до помірного забарвлення розчину і титрують до зміни кольору від червоного до синьо-фіолетового. Вміст іонів Ca2+ розраховують за тією ж формулою, що у досліді 3а. вміст іонів Mg2+ знаходять з формули: ЖЗ=ЖCa2+ + ЖMg2+
У висновках укажіть: яку ступінь жорсткості має досліджена вами проба води?
8.5. Список рекомендованої літератури
1. Глинка Н.Л. Загальна хімія. – Л.: Хімія, 1988. – С.197, 596-599.
2. Глинка Н.Л. Задачі і вправи по загальній хімії. – Л.: Хімія, 1985. – С. 234-235.
3. Пилипенко А.Г., Починок В.Я., Середа И.П. і ін. Довідник по елементарній хімії. – Київ.: Наук. думка, 1985. – С. 165-167.








