Дослід 2. Приготування розчину кислоти
Визначають за допомогою ареометра густину кислоти, отриманої для досліду, і по таблиці – його процентну концентрацію. Методом розведення готують розчин із заданою масовою часткою відповідно до варіанту (табл. 5). Розрахунок проводять за правилом хреста.
Визначають по таблиці густину приготовленого розчину.
Методом прямого титрування уточнюють концентрацію розчину.
Т а б л и ц я 5
Варіанти завдань до лабораторної роботи “Приготування розчинів”
| Варіанти | Маса розчину 100 г | Об¢єм титр. розчину 50 мл |
| 1 | 15% КОН | 0,12 н |
| 2 | 12% NаОН | 0,15 н |
| 3 | 16% КОН | 0,08 н |
| 4 | 10% NаОН | 0,1 н |
| 5 | HCl 10% | 0,1 н |
| 6 | H2SO4 8% | 0,08 н |
| 7 | H2SO4 5% | 0,07 н |
| 8 | H2SO4 10% | 0,1 н |
| 9 | HCl 8% | 0,1 н |
| 10 | HNO3 10% | 0,1 н |
7.5. Список рекомендованої літератури
1. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.205-215
2. Глинка Н.Л.Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 103-114.
3. Сухан В.І., Табенська Т.В., Капустян А.Й., Горлач В.Ф. Посібник для вступників до вищих навч. закладів. – Київ.: Либідь, 1996. – С.132-138.
4. Булавін В.І. Основи загальної хімії. – Харків.: ХДПУ, 1998. – С.28-42.
5. Пилипенко А.Г., Починок В.Я., Середа И.П. і ін. Довідник по елементарній хімії. – Київ.: Наук. думка, 1985. – С. 153-165.
6. Кириченко В.І. Загальна хімія: Навч. посіб. – К.: Вища шк., 2005. – С.224-244).
Т е м а 8. Твердість (жорсткість) води і методи її усунення
8.1. Рекомендації до вивчення теоретичного матеріалу
При виконанні завдань по цій темі необхідно звернути увагу на наступне:
Розрізняють твердість(жорсткість) некарбонатну (постійну) і карбонатну (тимчасову). Наявністю в природній воді Са(НСО3)2 і Mg(HCO3)2 обумовлюється карбонатна твердість води, некарбонатна – наявністю хлоридів і сульфатів магнію і кальцію. Карбонатна і некарбонатна твердість складають загальну твердість води в м екв/л (миліеквивалент/л).
У лабораторії карбонатну твердість(жорсткість) води (Жтимч.) звичайно визначають методом титрування визначеного об¢єму води розчином соляної кислоти відомої концентрації в присутності індикатора метилоранжу. При титруванні протікають реакції:
Са(НСО3)2+2НСl ® CaCl2+2H2O+2CO2
Mg(HCO3)2+2HCl ® MgCl2+2H2O+2CO2.
Розрахунок роблять за формулою: V1×CH1 = V2 ×CH2, де V1 – об¢єм води в мл; V2× - об¢єм кислоти, витраченої на титрування; CH1 – нормальність розчину солей у воді; CH2 – нормальність кислоти. Звідси: СН1 = 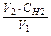 ; Ж = Сн1×103 (м екв/л).
; Ж = Сн1×103 (м екв/л).
При розв¢язуванні задач можна також користуватися формулою: Ж = 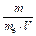 , де m – маса речовини в мг, що обумовлює жорсткість води або солі, яку застосовували для її усунення; mе – еквівалентна маса цієї речовини; V – об¢єм розчину в л.
, де m – маса речовини в мг, що обумовлює жорсткість води або солі, яку застосовували для її усунення; mе – еквівалентна маса цієї речовини; V – об¢єм розчину в л.
Щоб усунути жорсткість води, потрібно зв'язати іони Са2+ і Мg2+ у нерозчинні сполуки, використовуючи таблицю розчинності. Для осадження іонів кальцію і магнію використовують переважно соду Na2CO3, вапно Са(ОН)2 чи фосфат натрію Na3PO4. Тимчасова жорсткість води може бути усунута тривалим кип'ятінням. При цьому протікають такі реакції:
Са(НСО3)2 ® CaCО3¯+Н2О+СО2
Mg(HCO3)2 ® Mg(OH)2¯+2CO2.
8.2. Приклади розв ¢язування типових задач
Задача 1. Запропонуйте способи усунення тимчасової і постійної твердості (жорсткості) води.
Рішення. Для усунення тимчасової жорсткості, крім методу кип'ятіння, використовують методи осадження:
- вапняний метод: Са(НСО3)2+Са(ОН)2 ® 2СаСО3¯+2Н2О
Mg(HCO3)2+2Са(ОН)2®2СаСО3¯+Mg(OH)2¯+2H2O
- натронний метод: Са(НСО3)2+2NaOH ®СаСО3¯+Na2CO3+2H2O
Mg(HCO3)2+4NaOH ® Mg(OH)2¯+2Na2CO3+2H2O
- содовий метод: Са(НСО3)2+Na2CO3® СаСО3¯+2NaHCO3
Mg(HCO3)2+ Na2CO3® MgCO3 ¯+2NaHCO3
Для видалення постійної жорсткості можна використовувати:
- содовий метод: CaSO4+ Na2CO3® CaCO3¯+Na2SO4
MgSO4+Na2CO3® MgCO3¯+Na2SO4
- фосфатний метод: 3 CaSO4+2Na3PO4® Ca3(PO4)2¯+3Na2SO4
3MgSO4+2Na3PO4®Mg3(PO4)2¯+3Na2SO4
Задача 2. Обчислити жорсткість води, знаючи, що в 500 л її міститься 202,6 г Са(НСО3)2.
Рішення. Визначаємо еквівалентну масу Са(НСО3)2: mе= 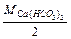 = 162:2=81(г/моль). Знаходимо жорсткість води за формулою:
= 162:2=81(г/моль). Знаходимо жорсткість води за формулою:
Ж = 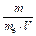 =
= 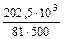 =5 м екв/л.
=5 м екв/л.
Задача 3. Обчислити карбонатну жорсткість води, знаючи, що на титрування 100 мл цієї води витрачено 6,25 мл 0,008 н. розчину НСl.
Рішення. Підставляємо дані у формулу: V1×CH1 = V2×CH2
100×Сн1 = 6,25×0,008 ; Сн1 = 0,005 екв/л.
Оскільки жорсткість води виражається в мекв/л, то: Ж = Сн1×103 = 5 м екв/л.
8.3. Задачі для самостійного розв ¢язування: 1030, 1031, 1035, 1037
8.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: склянки з пробами води, мірні циліндри, бюретки з розчином хлоридної (соляної) кислоти, лужної суміші, колби на 100 мл, розчин метилоранжу, фільтрувальний папір, електроплитки; стандартний розчин трилона Б – 0, 05 н., індикатори – мурексид, хромоген чорний Т.








