Дослід 1. Приготування розчину лугу
а) приготування розчину лугу зазначеної процентної концентрації відповідно до варіанта завдання (табл. 5).
Розраховують, яку масу гранульованого лугу необхідно взяти для приготування 100 г розчину з зазначеною в завданні масовою часткою. Зважують розраховану кількість лугу на техно-хімічних вагах з точністю до 0,1 г і переносять у колбу на 100 мл. Відмірюють циліндром необхідну кількість води. Після охолодження розчину до кімнатної температури вимірюють його щільність ареометром і порівнюють отриману величину з табличними даними;
б) приготування розчину лугу зазначеної нормальної концентрації відповідно до варіанта завдання (табл. 5), використовуючи розчин, отриманий у досліді а.
Розраховують, який об¢єм вихідного розчину необхідний для приготування 50 мл розчину з концентрацією Сн:
Vр-ну = 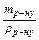 ,
,
mр-ну = 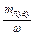 , тому: Vр-ну =
, тому: Vр-ну = 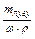 . Масу розчиненої речовини mлугу знаходять : mлугу = Сн×mекв(лугу)×V, відкіля випливає, що об¢єм вихідного розчину складає:
. Масу розчиненої речовини mлугу знаходять : mлугу = Сн×mекв(лугу)×V, відкіля випливає, що об¢єм вихідного розчину складає:
Vр-ну = 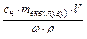 .
.
Відбирають піпеткою розрахований об¢єм розчину і переносять у мірну колбу на 50 мл. За допомогою піпетки доливають дистильованої води до відповідної мітки, орієнтуючись на нижній меніск;
в) перевірка нормальності приготовленого в досліді б розчину методом прямого титрування.
Якщо точно вимірити об¢єми розчинів хімічних речовин, що вступили в реакцію (у даному випадку кислоти і лугу), і знати концентрацію одного розчину (кислоти), то легко обчислити концентрацію іншого (лугу). Процес поступового додавання розчину з відомою концентрацією речовини (титрованного розчину) до точно обмірюваного об¢єму аналізованого розчину називається титруванням.
За допомогою піпетки відбирають 3 проби аналізованого розчину лугу по 10 мл і додають у кожну пробу 3-4 краплі фенолфталеїну.
Проводять орієнтований дослід: невеликими порціями доливають кислоту з бюретки в колбу з лугом до зникнення забарвлення фенолфталеїну. Розчин у колбі перемішують під час досліду легкими круговими рухами колби. Роблять відлік об¢єму витраченої кислоти з точністю до десятих часток мл. Виходячи з закону еквівалентів: Сн к×Vк = Cн лугу×Vлугу, розраховують нормальну концентрацію приготовленого розчину.
Повторюють титрування ще два рази, уточнюючи концентрацію розчину.








