М о д у л ь 3. РОЗЧИНИ
Т е м а 7. Розчинність. Способи вираження концентрації
7.1. Рекомендації до вивчення теоретичного матеріалу
При вивченні даної теми необхідно звернути увагу на наступні основні поняття теорії розчинів.
Розчини являють собою дисперсні системи, в яких частинки однієї речовини рівномірно розподілені в іншій. У дисперсних системах розрізняють дисперсійне середовище (розподіляюче середовище) і дисперсну фазу (подрібнену в дисперсійному середовищі речовину), які можуть існувати в трьох агрегатних станах (Г- газ, Р- рідина, Т- тверда речовина). Отже, можливі 9 типів дисперсних систем, але до розчинів найчастіше відносять системи Г + Р, Р + Р, Т + Р (перша буква – дисперсна фаза, друга – дисперсне середовище).
Залежно від розмірів частинок дисперсної фази розрізняють істинні розчини (частинки з розміром 0,1-1 нм), колоїдні системи (1-100 нм) і грубодисперсні системи (розмір частинок більше 100 нм). До грубодисперсних систем належать суспензії, емульсії, піни. Слід звернути увагу на відмінні властивості істинних розчинів від властивостей інших систем.
Істинні розчини – це гомогенні термодинамічно стійкі дисперсні системи, що складаються з двох і більше компонентів, здатних існувати незалежно один від одного, співвідношення між якими може варіювати в широких межах. Розмір частинок дисперсної фази в них дорівнює розмірам молекул або іонів.
Необхідно ознайомитися з механізмом і термодинамікою процесу розчинення, звернувши увагу, що інтегральна теплота розчинення (∆Нр.) відбиває вплив двох факторів - ∆Н фазового переходу речовини дисперсної фази (або енергію її кристалічної гратки) і ∆Н сольватації:
∆Нр. =Δ Н ф.п. + ∆Н сольв.
Отже, при розчиненні речовин завжди спостерігається виділення або поглинання теплоти. Ентропія систем Р + Р і Т + Р зростає (∆S > 0), оскільки речовини з більш впорядкованого стану переходять у менш впорядкований. При розчиненні газів ентропія системи Г + Р зменшується (∆S < 0). Але в усіх випадках ізобарно-ізотермічний потенціал завжди зменшується (∆G p. < 0), тобто, розчинення – самовільний процес.
Слід звернути увагу на розчинність органічних і неорганічних речовин у воді і інших розчинниках (спиртах, кетонах, ефірах, вуглеводнях і т. д.), користуючись відомим правилом: «подібне розчиняється в подібному». Наприклад, полярні розчинники, вода, ацетон, етанол, диметилформамід, ацетонітрил змішуються і розчиняються один в одному в необмеженому співвідношенні. Практично відсутня взаємна розчинність у системах з протилежними властивостями компонентів: вода-октан, вода-бензол. При розчиненні газів в рідині можливе утворення двох систем: з наявністю хімічної взаємодії та з її відсутністю. У випадку наявності хімічної взаємодії (наприклад, розчинення NH3, НCl, HBr у воді) розчинність газів значно вища, ніж при її відсутності (O2, N2, CO, інертні гази). В останньому випадку залежність розчинності газів від тиску виражається законом Генрі-Дальтона (1802): при сталій температурі розчинність газу в рідині (С) прямо пропорційна його парціальному тиску (Р):
С = k ·Р,
де k – коефіцієнт пропорційності.
Розчини з великою концентрацією розчиненої речовини називаються концентрованими, а з малою – розведеними. Коли розчин знаходиться в динамічній рівновазі з одним з компонентів розчину, він називається насиченим, а його концентрація відповідає розчинності цього компонента. Під розчинністю звичайно розуміють масу розчиненої речовини в 100 г розчинника в насиченому розчині.
У практиці насиченими розчинами користуються рідко, характеризувати концентрацію розчину величиною розчинності незручно. У зв'язку з цим для кількісної характеристики розчинів застосовують інші способи вираження концентрації. Вони досить докладно розглянуті в задачнику М.Л. Глінки. Варто запам'ятати основні п'ять способів:
1. Частки – мольна (об'ємна, масова) – відношення кількості молей (об¢єму, маси) однієї з речовин до суми кількості молей (об¢ємів, мас) усіх речовин суміші:
мольна - ХА= 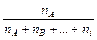 ;
;
об'ємна - jА= 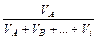 ;
;
масова - 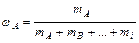 .
.
Сума часток суміші дорівнює одиниці: 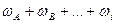 =1.
=1.
2. Моляльність – число молів розчиненої речовини в 1000 г розчинника;
Сm = 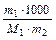 (моль/кг), де m1, m2 – маси розчиненої речовини і розчинника, г.
(моль/кг), де m1, m2 – маси розчиненої речовини і розчинника, г.
3. Молярність – число молів розчиненої речовини в 1 л розчину;
СМ = 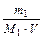 (моль/л), де V – об¢єм розчину, л.
(моль/л), де V – об¢єм розчину, л.
4. Нормальність (молярна концентрація еквіваленту) – число молів еквівалентів розчиненої речовини в 1 л розчину;
Сн = 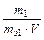 (моль екв/л); mэ1 – еквівалентна маса розчиненої речовини.
(моль екв/л); mэ1 – еквівалентна маса розчиненої речовини.
5. Титр – кількість грамів розчиненої речовини, що містяться в 1 мл розчину; Т = 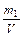 (г/мл).
(г/мл).
При визначенні концентрації невідомого розчину методом титрування використовують закон еквівалентів, що для розчинів має вид:
Сн1×V1 = Сн2 ×V2.
При розчиненні у воді малорозчинних неорганічних речовин ( наприклад, BaSO4, Ag2ClO4, Fe(OH)3, AgCl ) більша частина речовини залишається в осаді, між яким та насиченим розчином встановлюється рівновага:
BaSO4 = [BaSO4] =Ва2+ + SO4²ˉ,
константа якої має вираз: К = [ Ва2+] [SО42ˉ] / [ВаSО4 тв. ] Оскільки в розчин переходить незначна частина сульфату барію, то можна констатувати, що кількість твердої фази при сталій температурі практично не змінюється. Отже, [Ва2+] [SО42ˉ] = К·[ВаSО4 тв.] = const = ДР.
Добуток розчинності (ДР) – показник розчинності: чим менша величина ДР, тим менше речовина здатна переходити в розчин. Розчинність малорозчинної речовини легко знайти, якщо скористатися табличними даними добутку розчинності.
Наприклад, розчинність ВаSО4 знаходять з таких співвідношень:
[BaSO4] = [ Ва2+] = [SО42ˉ] = √ДР = √1,1·10-10 = 1,08·10-5 моль/л = 1,08·MBaSO4·10-5 ≈ 2,5·10-3 г/л . Аналогічно, розчинність Ag2CrO4 дорівнює
[Ag2CrO4] = [ CrO42ˉ] = 3√ДР/4 = 3√4.05·10-12 ≈ 1·10-4 моль/л
У насиченому розчині малорозчинної сполуки KmAm встановлюється рівновага:
KmAn = mKn+ + nAm-
тверда фаза насичений розчин
Тобто, ДР = [Kn+]m · [Am-]n. У загальному вигляді розчинність KmAn в моль/л визначають за формулою:
P KmAn = m+n√ДР(KmAn)/(mm · nn)
Додавання однойменного іону в систему «осад-розчин» буде зміщувати рівновагу в бік випадання осаду.
7.2. Приклади розв ¢язування типових задач
Задача 1. Визначити молярну, нормальну концентрації і титр 40%-го розчину Н2SO4 (1,31 г/см3).
Розв’язок. З формули 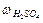 =
= 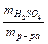 знаходимо масу розчиненої речовини Н2SO4: m
знаходимо масу розчиненої речовини Н2SO4: m 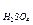 =
= 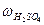 ×mр-ну. =
×mр-ну. = 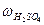 ×
× 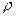 ×V = 0,40×1,31г/мл×1000 мл = 524 (г), (де V = 1000 мл).
×V = 0,40×1,31г/мл×1000 мл = 524 (г), (де V = 1000 мл).
Знаходимо молярну концентрацію: СМ = 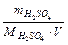 =
= 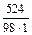 = 5,35 (моль/л).
= 5,35 (моль/л).
Знаходимо нормальну концентрацію: Сн = 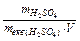 =
= 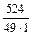 = 10,7 (моль-екв/л).
= 10,7 (моль-екв/л).
Знаходимо титр: Т = 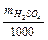 =
= 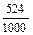 = 0,524 (г/мл).
= 0,524 (г/мл).
Задача 2. Скільки грамів Na2CO3 необхідно для повної взаємодії його з 100 мл 4 н. розчину НСl ?
Розв’язок. Відповідно до закону еквівалентів: 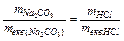 .
.
З формули Сн = 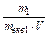 випливає:
випливає: 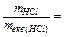 VHCl×CH Þ Комбіноване вираження закону еквівалентів має вид для даного випадку:
VHCl×CH Þ Комбіноване вираження закону еквівалентів має вид для даного випадку: 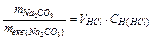 Þ mNa
Þ mNa 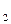 СО
СО 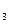 =mекв(Na
=mекв(Na 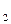 СО
СО 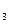 )×VHCl×CH(HCl) =53×0,1×4 =
)×VHCl×CH(HCl) =53×0,1×4 =
= 21,2 (г).
Задача 3. У лабораторії є розчин із процентною концентрацією натрій хлориду 20 і 10%. Визначите масу кожного з розчинів, які необхідно змішати для приготування 300 г розчину з процентною концентрацією 12%.
Розв’язок. При виконанні експериментальних робіт часто доводиться розраховувати концентрацію розчину, що утворюється при розведенні, концентруванні або змішуванні двох розчинів. У цьому випадку зручно використовувати «правило хреста»:
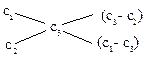 |
де С1 і С2 – концентрації вихідних, С3 – кінцевих розчинів, причому С1>C3, а С3>C2. Для масових значень вираження концентрації знаходимо:
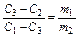 ; для об'ємних:
; для об'ємних: 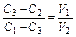 . У випадку розведення розчину чистим розчинником С2 приймається рівним нулю. Цю задачу також можна вирішити за допомогою “правила хреста”. Складаємо діаграму:
. У випадку розведення розчину чистим розчинником С2 приймається рівним нулю. Цю задачу також можна вирішити за допомогою “правила хреста”. Складаємо діаграму:
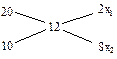
де х1 і х2 – відповідні масові частини розчинів. Як випливає з цієї діаграми, для приготування необхідного розчина варто взяти 2 масові частини 20% і 8 масових частин 10% розчинів.
Розрахуємо маси кожного з розчинів по формулах:
m1 = 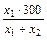 =
= 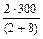 = 60(г); m2 =
= 60(г); m2 = 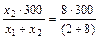 = 240 (г) або m2 = 300 – m1 = 300-60 = 240 (г).
= 240 (г) або m2 = 300 – m1 = 300-60 = 240 (г).
Задача 4: Визначити розчинність Ca3(PO4)2 в моль/л і в г/л.
Розв’язок: У водному розчині Ca3(PO4)2 дисоціює за рівнянням:
Ca3(PO4)2 = 3 Ca 2+ + 2PO43-
Тобто, трьом катіонам Ca 2+ відповідають два аніона PO43ˉ. Розчинність фосфату кальцію визначають з урахуванням значення добутку розчинності:
ДРCa3(PO4)2 = [Ca 2+ ]3 · [PO43-]2 = 3 ·10-33
Р Ca3(PO4)2 = 3+2√ПРCa3(PO4)2/33· 22 = 5√3 · 10-33/108 ≈ 1,2 · 10-7 моль/л
Молярна маса Ca3(PO4)2 дорівнює 310 г/моль. Отже, РCa3(PO4)2 = 1,2 · 10-7 ·310 = 3,72 · 10-5 г/л.
7.3. Задачі для самостійного рішення: 400, 414, 421, 432, 436
7.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: техно-хімичні ваги і важок, набір ареометрів для визначення густини розчинів, мірні колби на 50 і 100 мл, піпетки, гранульовані луги – КОН і NaOH, розчини кислот невідомої концентрації: соляної, сірчаної, азотної; дистильована вода.








