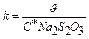Дослід 1. Вплив концентрації реагуючих речовин на швидкість реакції в гомогенній системі
Загальні вказівки
Цю залежність можна виявити на прикладі реакції взаємодії водного розчину тіосульфату натрію з сірчаною кислотою, що протікає за рівнянням:
Na2S2O3 + H2SO4 ® Na2SO4 + Н2О + SO2 + S¯.
Досліджувана реакція протікає в кілька стадій:
1) Na2S2O3 + H2SO4 ® Na2SO4 + H2S2O3;
2) H2S2O3 ® H2SO3 + S¯; 3) H2SO3 ® Н2О + SO2.
Реакції 1,3 протікають миттєво. Найбільш повільною є реакція 2, що і визначає загальну швидкість реакції. Ця реакція є реакцією першого порядку. Нерозчинна сірка виділяється у виді блакитнувато-білої опалесценції (каламуть). Час від початку реакції до появи перших слідів каламуті залежить від концентрації реагуючих речовин і температури. Для реакції першого порядку швидкість хімічних реакцій можна знайти по формулі: V = 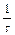 , де
, де 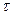 - час протікання реакції.
- час протікання реакції.
Хід роботи:
Проводять контрольний дослід: наливають у пробірку 1 мл розчину H2SO4, в іншу пробірку – 5 мл розчину Na2S2O3. Доливають у пробірку з кислотою розчин тіосульфату натрію і добре струшують. Спостерігають початок реакції по появі блакитнувато-білої опалесценції.
Проводять ще п'ять аналогічних дослідів, змінюючи концентрацію розчину Na2S2O3 шляхом розведення його водою відповідно до даних таблиці 3. Зливають попарно приготовлені розчини (розчин 1 вливають у розчин 2) і відраховують час по секундоміру з моменту зливання розчинів до початку появи каламуті. Дані досліду заносять у таблицю 3.
Т а б л и ц я 3
Експериментальні дані залежності υ = f( c)
| №п/п | Розчин 1 | Розчин 2 V H2SO4 мл | Vзаг | С* Na2S2O3 ´10-2 моль/л |
|
´10-2, c-1 |
| |
| V Na2S2O3 Мл | V H2O мл | |||||||
| 1 | 1 | 4 | 1 | 6 | ||||
| 2 | 2 | 3 | 1 | 6 | ||||
| 3 | 3 | 2 | 1 | 6 | ||||
| 4 | 4 | 1 | 1 | 6 | ||||
| 5 | 5 | - | 1 | 6 | ||||
Розраховують концентрації С*(Na2S2O3) за формулою:
С*( Na2S2O3) = 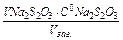 моль/л, де С0(Na2S2O3) = 0,1 моль/л,
моль/л, де С0(Na2S2O3) = 0,1 моль/л,
С0(H2SO4) = 0,5 моль/л .
Розраховують 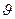 – швидкість реакції. Розраховують k – константу швидкості. Будують графік залежності швидкості реакції від концентрації реагуючих речовин. На осі абсцис відкладають у визначеному масштабі відносні концентрації тіосульфату натрію, на осі ординат – відповідні їм швидкості.
– швидкість реакції. Розраховують k – константу швидкості. Будують графік залежності швидкості реакції від концентрації реагуючих речовин. На осі абсцис відкладають у визначеному масштабі відносні концентрації тіосульфату натрію, на осі ординат – відповідні їм швидкості.
Дослід 2. Вплив температури на швидкість реакції в гомогенній системі
Готують розчини другого досліду відповідно до таблиці 4.
Т а б л и ц я 4
Експериментальні дані залежності υ = f ( t)
| № п/п | Розчин 1 | Розчин2 V H2SO4 мл | Vзаг. | t, 0C |
|
|
10-2, c-1 |
| |
| V Na2S2O3 мл | V H2O мл | ||||||||
| 1 | 2 | 3 | 1 | 6 | 20 | ||||
| 2 | 2 | 3 | 1 | 6 | 30 | ||||
| 3 | 2 | 3 | 1 | 6 | 40 | ||||
| 4 | 2 | 3 | 1 | 6 | 50 | ||||
| 5 | 2 | 3 | 1 | 6 | 60 | ||||
Готують п'ять пробірок з розчином 1 і п'ять пробірок з розчином 2.
Кожну пару пробірок (розчинів 1 і 2) термостатують у хімічній склянці з водою, температура якої зазначена в таблиці. Воду в хімічній склянці нагрівають на електроплитці (на 2-3 градуса вище температури, зазначеної в таблиці). Температуру контролюють по термометру, зануреному в склянку з водою, що нагрівається. Довівши температуру до необхідного значення, зливають вміст пробірок (розчин 1 доливають до розчину 2) і визначають час до появи каламуті. Дані досліду заносять у таблицю і розраховують 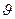 – швидкість реакції, k – константу швидкості і температурний коефіцієнт
– швидкість реакції, k – константу швидкості і температурний коефіцієнт 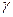 із формули:
із формули: 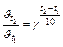 ;
;
Будують графік залежності швидкості реакції від температури. На осі абсцис відкладають значення температури, на осі ординат – відповідні їм швидкості.
У висновках укажіть:
- Як змінювалася швидкість реакції зі зміною концентрації тіосульфату натрію?
- Чи залежить константа швидкості від концентрації і температури?
- Як впливає температура на швидкість реакції?
- Яке значення має температурний коефіцієнт однієї і тієї ж реакції?
Дослід 3. Вплив каталізатора на швидкість реакції
У дві пробірки вносять по 1 - 2 мл 0,5 н. розчину калій роданіду KSCN і по 2 - 3 краплі 0,5 н. розчину ферум (3+) хлориду. Що спостерігаєте?
В одну з пробірок додають 2 – 3 краплі 1 н. розчину купрум сульфату CuSO4. В обидві пробірки вносять невелику кількість тіосульфату натрію. Спостерігають різну швидкість знебарвлення розчинів, що відбувається унаслідок відновлення ферум (3+) до ферум (2+):
2Fe(SCN)3 + 2Na2S2O3 ® Na2S4O6 + 2Fe(SCN)2 +2NaSCN.
Відзначають усі спостереження і записують рівняння реакцій:
- взаємодії ферум (3+)хлориду з роданідом калію з утворенням Fe(SCN)2;
- відновлення ферум (3+) у ферум (2+) натрій тіосульфатом. Яке забарвлення має Fe(SCN)2?
У висновку вкажіть: що з'явилося каталізатором у даному досліді?
6.2. Список рекомендованої літератури
1. Фролов В.В. Химия. – М.: Высш. шк., 1986. – С.114-135.
2. Курс общей химии/Под ред. Коровина А.В. – М.: Высш. шк., 1985. – С.107-144.
3. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.162-181.
4. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С.86-102.
5. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С. 191 – 224 (2001. – С. 212-226).
6. Слободяник М.С., Улько Н.В., Бойко К.М., Самойленко В.М. Загальна та неорганічна хімія: Практикум . – К.: Либідь, 2004. – 336 с.









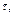 с
с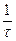
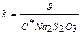
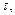 с
с