Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
6.1. Рекомендації до вивчення теоретичного матеріалу Хімічна термодинаміка передбачає лише можливість самовільного перебігу процесу. На питання про те, як швидко здійсниться ця можливість, відповідає хімічна кінетика – розділ хімії, який вивчає швидкість і механізм хімічних перетворень. Швидкість будь-якої хімічної реакції визначається зміною концентрації однієї з реагуючих речовин за одиницю часу. Очевидно, швидкість реакції обумовлена числом елементарних актів реакції за одиницю часу в одиниці об’єму (для гомогенних реакцій) або на одиницю поверхні поділу фаз (для гетерогенних реакцій).
На швидкість реакції впливають численні фактори: природа реагуючих речовин, концентрація реагентів, температура, наявність каталізатора або інгібітора, тиск (для газів), ступінь подріблення (для гетерогенних систем), природа розчинника, форма реактора (для ланцюгових реакцій), інтенсивність світла (для фотохімічних процесів), високочастотне випромінювання і таке інше. Таким чином, хімічна кінетика – це великий розділ хімії, задачею якого є визначення всіх кінетичних факторів з метою цілеспрямованого впливу на напрямок і швидкість реакції для досягнення максимального бажаного результату. За програмою для інженерних спеціальностей в курсі загальної хімії студенти знайомляться лише з основними положеннями хімічної кінетики.
Необхідною умовою перебігу хімічного процесу є зіткнення молекул. Тому необхідно уважно розглянути положення теорії активних зіткнень, згідно якої число активних зіткнень (Nа) дорівнює:
Nа = N0 . e-Ea/RT , звідки: kT = P . Z. e-Ea/RT ,
де N0 – стала Максвелла-Больцмана; kT – константа швидкості реакції при температурі Т; P - фактор ймовірності (стеричний фактор), який вимагає певної орієнтації в просторі молекул під час зіткнення (фактор доступності реакційного центру); Z – частотний фактор, тобто число зіткнень в одиниці об’єму за одиницю часу при концентрації, що дорівнює одиниці; Еа – енергія активації, це надлишок енергії, який повинні мати реагуючі молекули порівняно з середньою енергією всієї системи, щоб між ними відбулася реакція. Енергія активації – це той мінімум енергії (“енергетичний бар’єр”), який необхідний для переходу реагуючих молекул у стан активного комплексу (теорія активного комплексу).
A B A … B A — B
| + | 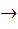 : :
: :  +
+
A B A … B A — B
початковий стан перехідний стан кінцевий стан
(вихідні реагенти) (активований комплекс) (продукти реакції)
Для термодинамічно дозволених ( 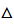 G
G 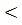 0) реакцій знайдено, що реакція відбувається з достатньою швидкістю при умові Еа
0) реакцій знайдено, що реакція відбувається з достатньою швидкістю при умові Еа 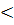 150 кДж/моль. Наприклад: NO + ½ O2 → NO2 ( безбарвний газ NO у повітрі перетворюється дуже швидко у бурий газ NO2). Енергія активації для цієї реакції дорівнює ≈ 80 кДж/моль.
150 кДж/моль. Наприклад: NO + ½ O2 → NO2 ( безбарвний газ NO у повітрі перетворюється дуже швидко у бурий газ NO2). Енергія активації для цієї реакції дорівнює ≈ 80 кДж/моль.
Основний закон хімічної кінетики - закон діючих мас (К.М.Гульдберг, П. Вааге, 1867 р.), який для гомогенної реакції: аА + bВ → cC + dD має математичний вираз:
υ = k·[А]а·[В]b
Для гетерогенних реакцій треба враховувати питому поверхню (S): при значній дисперсності (подрібненості) твердої речовини величина загальної поверхні входить до кінетичного рівняння. Наприклад, якщо А – тверда речовина, то:
υ = k·SА·[В]b
Для газів в математичному виразі закону діючих мас концентрацію замінюють на парціальний тиск газуватих речовин: υ = k . РАa . РВ b
Константа швидкості за фізичним змістом – це швидкість реакції при умові, що концентрації (або тиск - для газів) реагуючих речовин дорівнюють одиниці. Тоді: υ = k.
Залежність швидкості реакції від температури виражає емпіричне правило Я.Вант-Гоффа (1884 р.): при підвищенні температури на кожні 10 градусів швидкість реакції збільшується в 2 – 4 рази: υt2 /υt1 = γΔt10, де γ – температурний коефіцієнт Я.Вант-Гоффа).
Більш універсальною характеристикою залежності швидкості реакції від температури є рівняння С. Арреніуса : kT = A . e-Ea/RT , або: lnk = lnA - Ea/RT .
Логарифмічний вираз являє собою рівняння прямої у координатах lnk - 1/T, тангенс кута нахилу якої (tg α) дорівнює Еа/R. Тобто, енергію активації реакції можна визначити за даними експерименту.
Слід звернути увагу на механізм дії каталізаторів і використання їх для прискорення хімічних процесів. В усіх випадках суть каталізу – зниження енергії активації в реагуючій системі. У деяких випадках на практиці використовують інгібітори ( ”антикаталізатори” ) – речовини, що уповільнюють хімічний процес.
Питання хімічної рівноваги варто розглядати, виходячи з того, що всі хімічні реакції можна розділити на оборотні і практично необоротні. У момент настання рівноваги пряма і зворотна реакції не припиняються, а продовжують протікати з рівними швидкостями, тобто рівновага є динамічною. Для реакції, записуваної в загальному виді: aА+bВ ® cС+dD у стані рівноваги, виконується співвідношення: 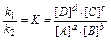 , де k1, k2 – константа швидкості прямої і зворотної реакції; К – константа рівноваги.
, де k1, k2 – константа швидкості прямої і зворотної реакції; К – константа рівноваги.
Слід зазначити, що у вираження константи рівноваги гетерогенної реакції входять тільки концентрації речовин, що знаходяться в рідкій і в газовій фазі, тому що концентрації твердих речовин умовилися вважати постійними (рівними 1). Значення константи рівноваги не залежить від концентрації, парціальних тисків для реакцій у газовій фазі, але залежить від природи реагуючих речовин і температури. Використання каталізаторів не змінює константу рівноваги, а лише скорочує час, необхідний для досягнення стану рівноваги.
Стан хімічної рівноваги зберігається доти, поки зовнішні умови залишаються незмінними. При зміні зовнішніх умов (концентрація, тиск, температура) система виходить зі стану рівноваги, тому що швидкість прямої і зворотної реакції змінюються в неоднаковому ступені. Вплив, що робиться на рівноважну систему зовнішнім впливом, можна передбачити, користаючись принципом Ле-Шательє: якщо на систему, що знаходиться в рівновазі, подіяти ззовні, то рівновага зміститься в такому напрямку, при якому цей вплив буде послаблено або знищено. Так, при введенні в систему одного з реагентів рівновага зміщається у бік його витрати, при підвищенні тиску – у бік меншого обсягу газів, при підвищенні температури – у бік ендотермічної реакції.
6.2.Приклади розв ¢язування типових задач
Задача 1. Як зміниться швидкість прямої реакції 2NO + Br2 ® 2NOBr, якщо тиск у системі збільшити в 3 рази?
Розв’язок. Позначимо вихідні тиски NO через Р1, а Br2 через Р2, тоді швидкість реакції дорівнює: 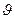 1 = kp×P21×P2. При збільшенні загального тиску в три рази парціальні тиски теж збільшаться в три рази NO = 3P1, Br2 = 3P2, а швидкість реакції
1 = kp×P21×P2. При збільшенні загального тиску в три рази парціальні тиски теж збільшаться в три рази NO = 3P1, Br2 = 3P2, а швидкість реакції 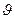 2 = kp×(3P1)2×(3P2). Þ
2 = kp×(3P1)2×(3P2). Þ 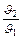 = 27. Таким чином, швидкість зростає в 27 разів.
= 27. Таким чином, швидкість зростає в 27 разів.
Задача 2. Як зросте швидкість реакції при підвищенні температури з 10 до 1000С, якщо температурний коефіцієнт швидкості дорівнює 2?
Розв’язок. Використовуємо правило Вант-Гоффа
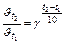 ;
; 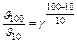 = 29 = 512.
= 29 = 512.
Швидкість зросте в 512 разів.
Задача 3. Для рівноважної системи СО + Н2О ↔ СО2 + Н2; К = 1. Визначити концентрації всіх речовин у стані рівноваги, якщо початкові концентрації [CO] = 2 і [ H2O] = 3 моль/л.
Розв’язок. Для даної рівноважної системи вираження константи рівноваги має вид:
К= 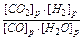 . Позначимо [СО2]р = [Н2]р = [СО]витр. = [Н2О]витр. = х , де [СО2]р, [Н2]р – відповідні рівноважні концентрації, а [СО]витр., [Н2О]витр.- витрачені концентрації.
. Позначимо [СО2]р = [Н2]р = [СО]витр. = [Н2О]витр. = х , де [СО2]р, [Н2]р – відповідні рівноважні концентрації, а [СО]витр., [Н2О]витр.- витрачені концентрації.
Оскільки СОр =СОпоч.– СОвитр., то [СО]р = (2-х), [Н2О]р = (3-х).
Тобто, 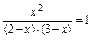 , звідки х = 1,2 моль/л.
, звідки х = 1,2 моль/л.
Отже, [СО]р = 2 - 1,2=0,8(моль/л); [Н2О]р = 3 - 1,2=1,8 (моль/л), [СО2]р = [Н2]р = 1,2 (моль/л).
6.3. Задачі для самостійного рішення: 330, 332, 334, 352
6.4. Лабораторна робота
Необхідні прилади, посуд і реактиви: секундомір, термостат, термометр, штативи з пробірками, скляні палички, розчини тіосульфату натрію, сірчаної кислоти, роданіду калію, хлориду заліза (3+), сульфату міді.








