Дослід 1. Визначення теплового ефекту реакції нейтралізації
Дослід проводиться в калориметрі (риc. 3).
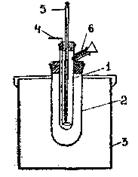 Калориметр складається з реакційної судини (1) ємністю 50 мл, що поміщений в ізотермічну оболонку (2) і (3). У пробці, що закриває реакційну судину, маються отвори для мішалки (4) і термометра (5). Розчини реагуючих речовин наливають через боковий відросток (6).
Калориметр складається з реакційної судини (1) ємністю 50 мл, що поміщений в ізотермічну оболонку (2) і (3). У пробці, що закриває реакційну судину, маються отвори для мішалки (4) і термометра (5). Розчини реагуючих речовин наливають через боковий відросток (6).
Рис.3. Скляний калориметр
Кількість теплоти, що виділяється чи поглинається в калориметрі, визначається по формулі: q = (tк – tн)SС, де tк – кінцева температура; tп– початкова температура; SС – теплоємність системи, що складається з теплоємності калориметричної судини і калориметричної рідини. SС = С1m1 + С2m2, де С1 і m1 -питома теплоємність і маса реакційної судини; С2 і m2 – ті ж величини для рідини, що знаходиться в калориметрі (сума маси води і розчиненої речовини). При використанні скляної реакційної судини теплоємністю калориметричної судини можна зневажити через його малу теплопровідність. Питому теплоємність розчинів можна прийняти рівній цій величині для води, тобто С2 = 4,18 Дж/м×К. Варто врахувати, що тепловий ефект реакції нейтралізації сильних кислот сильними (основами) лугами в розведених розчинах не залежить від їхньої природи, і взаємодія визначається реакцією: Н+ + ОН- ® Н2О(ж). Отже, при нейтралізації будь-якої сильної кислоти сильною основою повинний спостерігатися практично однаковий тепловий ефект DН0, що у міру розведення розчинів реагентів наближається до граничної величини, рівної: DН0298 = -55,9 кдж/моль (теплота нейтралізації).
Нейтралізації слабких кислот і основ передує процес дисоціації слабкої кислоти (основи) на іони, тому сумарна теплота нейтралізації в даному випадку менше, ніж 55,9 кдж/моль, тобто за законом Гесса можна визначити теплоту дисоціації.
Даний дослід зручно виконувати удвох або утрьох, тому що необхідно одночасно перемішувати рідину, стежити за секундоміром, фіксувати положення ртутного стовпчика в термометрі і проводити запис експериментальних даних.
Хід досліду:
Використовуючи вихідні 1н. розчини кислот і основ, відмірюють у 4 стаканчика по 25 мл кислоти і основи відповідно до отриманого завдання (табл.1).
Т а б л и ц я 1
Індивідуальні завдання по визначенню теплоти нейтралізації
| Варіант | Завдання | Варіант | Завдання |
| 1 | NaOH + HCl NaOH + HАc | 4 | KOH + HCl NH4OH + HCl |
| 2 | NaOH + H2SO4 KOH + HАc | 5 | KOH + H2SO4 NH4OH + H2SO4 |
| 3 | NaOH + HNO3 NH4OH + HNO3 | 6 | NaOH + HNO3 KOH + HAc |
Через лійку внутрішньої судини калориметра акуратно переливають розчин кислоти у внутрішню судину. Протягом декількох хвилин вимірюють температурний хід калориметра при постійному плавному перемішуванні кислоти, фіксують показання термометра з точністю до десятих часток градуса через кожні 0,5 хвилини.
Якщо в ході вимірів протягом 5 хвилин зміна температури рівномірна і невелика, починають експеримент, не припиняючи перемішувати розчин кислоти.
Переливають через лійку у внутрішню судину калориметра приготовлений розчин основи тієї ж концентрації.
Акуратно перемішують мішалкою розчин і стежать за швидким підвищенням температури, намагаючись вимірювати температуру системи через можливо малі інтервали часу (5-10 с). Фіксують максимальне значення (tк) ("стрибок" температури).
Після того, як зростання температури припиниться і стане рівномірно знижуватися, продовжують виміру ще не менш 5 хвилин при постійному перемішуванні розчину.
За результатами досліду будують на міліметровому папері графік у координатах температура (t, 0C) – час ( 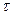 , хв), аналогічний приведений на рис. 3.
, хв), аналогічний приведений на рис. 3.
При побудові графіка варто пам'ятати, що оскільки усі виміри (часу і температури) проводяться з визначеною помилкою, спостерігається деякий розкид експериментальних даних. Тому лінії на графіку проводять не строго через експериментальні крапки, а у виді плавної кривої.
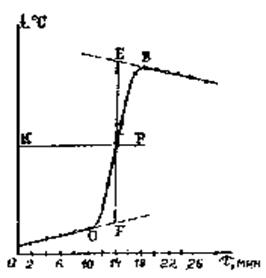
Рис. 4. Графік зміни температури в часі
Уточнюють за графіком Dt реакції.
Визначають загальну масу розчину: mр-ра = mк. + mл. = Vкrк + Vлrл, де Vк, Vл – об¢єми (мл); rк, rл – густина (г/мл) кислоти і луги відповідно;
rН2SO4 = 1,070; r HNO3 = 1,035; r NaOH = 1,0460;
r HCl = 1,023; r KOH = 1,050
Визначають кількість тепла, що виділилося: q = 4,18(mр-ну ((tк - tн).
Для визначення теплового ефекту (ентальпії DНнейтр) реакції перераховують теплоту, що виділилася, Q на 1 еквівалентну масу.
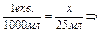 х =
х = 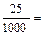 0,025 екв. Q =
0,025 екв. Q = 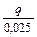 Дж; Q =
Дж; Q = 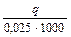 кДж Þ DНнейтр = -Q.
кДж Þ DНнейтр = -Q.
Оцінюють погрішність отриманого значення теплоти нейтралізації відносно табличного значення:
П = 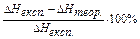 .
.
Знаючи, що при утворенні 1 моль води з іонів при кімнатній температурі виділяється 55,9 кДж, за законом Гесса визначають теплоту дисоціації оцтової кислоти чи гідроксиду амонію:
DН0дисс. = -55,9 - DН0нейтр. Результати обчислень заносять у таблицю (зразок)
| Електроліт | Dt, 0C | q, кДж | DНнейтр, кДж/моль | DНдис., кДж/моль |
| NaOH+HCl | ||||
| NaOH+Hac |
У висновках укажіть:
- виходячи з експериментальних і розрахункових даних, оцініть силу вивчених кислот і основ;
- чому тепловий ефект цієї реакції для сильних кислот і лугів у розведених розчинах не залежить від їхньої природи?
- поясніть відхилення отриманої експериментально теплоти нейтралізації від теоретичної.
Дослід 2. Визначення теплоти гідратації солі (елементи НДРС)
Загальні вказівки:
При виконанні даного досліду необхідно пам'ятати, що теплотою гідратації є кількість тепла, що витрачається на утворення 1 моль твердого кристалогідрату з твердої безводної солі і відповідної кількості води. Цю величину знаходять розрахунковим шляхом, ґрунтуючись на калориметричних даних по теплотам розчинення безводної солі і кристалогідрата в достатньо великих кількостях води.
Процес утворення розчину 1 моль безводної солі МеХn у y моль води можна здійснити двома шляхами відповідно до схеми: МеХn (тв.) + yН2О ® МеХn(розчинн.); DН01
Або через стадію утворення кристалгідрату МеХn×mН2O:
1. МеХn (тв.) + mН2О ® МеХn×mН2 O(тв.); DН0гідр.
2. МеХn×mН2O + (y- m)H2O ® МеХn(розчин.); DН02
Відповідно до закону Гесса, сумарні теплові ефекти в обох випадках рівні:
DН01 = DН0гідр. + DН02; DН0гідр. = DН01 - DН02.
Хід роботи:
1. Визначення постійної калориметра :
а) по відомій теплоті розчинення КNО3
Тепловий ефект процесу, що протікає в калориметрі (DН), можна розрахувати, виміривши точно стрибок температури D t у результаті досліду: DН0 = К×D t, де К – стала калориметра. За фізичним змістом стала і є теплоємність калориметра, чисельно рівна кількості тепла, необхідного для нагрівання всіх частин калориметра на один градус. Сталу калориметра визначають по відомій теплоті розчинення якої-небудь солі, наприклад, КNО3.
Для цього ретельно розтирають сіль у порцеляновій ступці і зважують з точністю до 0,01 г 2 г солі. Реакційну судину заповнюють точно 50 мл дистильованої води, закривають її пробкою і закріплюють у ній термометр 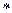 і мішалку. Після встановлення постійного значення температури в калориметрі, швидко висипають наважку нітрату калію і, розмішуючи акуратно розчин, спостерігають за зміною температури. Розраховують D t після того, як зміна температури припиниться.
і мішалку. Після встановлення постійного значення температури в калориметрі, швидко висипають наважку нітрату калію і, розмішуючи акуратно розчин, спостерігають за зміною температури. Розраховують D t після того, як зміна температури припиниться.
Визначають значення постійної калориметра К по рівнянню:
К = 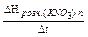 , де DН0розч.(КNО
, де DН0розч.(КNО 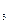 ) – відома теплота (ентальпия) розчинення, що дорівнює 34,93 кДж/моль при 298 К; n – кількість молів солі КNО3.
) – відома теплота (ентальпия) розчинення, що дорівнює 34,93 кДж/моль при 298 К; n – кількість молів солі КNО3.
б) по відомій кількості теплоти q ел., наданої калориметру (у випадку, якщо калориметр являє собою металеву судину)
Калориметричній системі за проміжок часу D 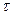 надається відома кількість теплоти qел. і виміряється відповідна зміна температури D t. Кількість теплової енергії qел., що надається калориметричній системі при електронагріві, визначається по формулі Джоуля: qел. = (U2× D
надається відома кількість теплоти qел. і виміряється відповідна зміна температури D t. Кількість теплової енергії qел., що надається калориметричній системі при електронагріві, визначається по формулі Джоуля: qел. = (U2× D 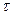 )/ r,
)/ r,
де U – напруга постійного струму, подавана на нагрівач, В; r – опір нагрівача, Ом; D 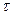 - час нагрівання калориметра, с. Тоді постійна калориметра: К = qел./D t.
- час нагрівання калориметра, с. Тоді постійна калориметра: К = qел./D t.
2. Визначення теплоти розчинення безводної солі і її кристалогідрату
Для проведення досліду використовують наважки солей, отриманих у викладача відповідно до варіантів завдань (табл. 2).
---------------------------
 Більш точно Dt визначають за допомогою метастатичного термометра Бекмана, правила роботи з яким варто з'ясувати у викладача.
Більш точно Dt визначають за допомогою метастатичного термометра Бекмана, правила роботи з яким варто з'ясувати у викладача.
Т а б л и ц я 2
Варіанти завдань і значення ∆Но розчинення солей
| Варіант | Сіль | DНрозч кДж/моль |
| 1 | СuSО4 СuSО4×5H2O | -66,5 11,70 |
| 2 | BaCl2 BaCl2×2H2O | -8,6 20,59 |
| 3 | MgSO4 MgSO4×7H2O | -84,96 16,1 |
| 4 | Na2SO4 Na2SO4×7H2O | -2,11 78,51 |
| 5 | Na2CO3 Na2CO3×10H2O | -24,60 66,58 |
Сіль беруть у кількості 0,01 моль і зважують з точністю до ( 0,01 г, попередньо розтерши в порошок . У калориметр наливають точно 50 мл дистильованої води, закріплюють термометр і мішалку.
Протягом декількох хвилин вимірюють температурний хід калориметра: при постійному плавному перемішуванні води, фіксують показання термометра з точністю до десятих часток градуса через кожні 0,5 хвилини.
Якщо в ході вимірів протягом 5 хвилин зміна температури рівномірна і невелика, починають експеримент, не припиняючи перемішувати воду.
Потім швидко висипають у калориметр наважки солі і, пермішуючи розчин, проводять виміри температур до повного розчинення солі (приблизно протягом 2-3 хвилин).
Фіксують максимальне значення (tк). Після того, як зростання температури припиниться і температура стане рівномірно знижуватися, продовжують виміри ще не менш 5 хвилин при постійному перемішуванні розчину.
Обробка даних і обчислення:
За результатами досліду малюють на міліметровому папері графік у координатах температура (t, 0C) – час ( 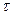 , хв.), аналогічний приведений на малюнку 3, по якому уточнюють значення Dt.
, хв.), аналогічний приведений на малюнку 3, по якому уточнюють значення Dt.
Молярну інтегральну теплоту розчинення солі і її кристаллогидрата DНрозч. МеХn×m Н2O визначають за формулою:
DН0розч. = (К×Dt)/n, де n = 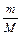 , m і М – наважка і молекулярна маса безводної солі чи кристалогідрату.
, m і М – наважка і молекулярна маса безводної солі чи кристалогідрату.
Визначають теплоту гідратоутворення за формулою:
DН0гідр = DН0розч. МеХn - DН0розч. МеХn×mН2 О.
Розраховують теоретичне значення теплот гідратації солей, користуючись довідковими даними. Знаходять відносну помилку визначення. Отримані результати заносять у таблицю .
| Сіль | m | Dt | K | n | Значенння DН0розч. | Значення DН0розч. | Відносна помилка, % | ||
| Табл. | експ. | табл. | експ. | ||||||
У висновках укажіть: як за допомогою наслідків із закону Гесса можно росередньо визначити DН0гідр.?
5.5. Список рекомендованої літератури
1. Фролов В.В. Химия. – М.: Высш. шк., 1986. – С.136-164.
2. Курс общей химии / Под ред. Коровина А.В. – М.: Высш. шк., 1985. – С.84-107.
3. Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.158-163.
4. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 71-86.
5. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С.159-175 (2001. – С.175-196).
6. Кириченко В.І. Загальна хімія: Навч. посіб. – К.: Вища шк., 2005. – С.119-138.








