М о д у л ь 2. Основні закономірності протікання хімічних реакцій
Т е м а 5. Енергетика хімічних процесів
5.1. Рекомендації до вивчення теоретичного матеріалу
Термодинаміка – загальна наука про умови перебігу процесів, що супроводяться зміною енергії у формі теплообміну та виконанням роботи різного виду. Хімічна термодинаміка встановлює основні закономірності енергетики хімічних перетворень, хімічної рівноваги, фазових переходів, процесів на межі поділу фаз.
Суть будь-якої реакції полягає в розриві хімічних зв’язків вихідних речовин (затрата енергії, ендоефект) і утворенні нових (виділення енергії, екзоефект). Величини цих ефектів ніколи не співпадають по модулю, отже, кожна реакція супроводжується енергетичним (найчастіше, тепловим) ефектом. Теплові ефекти розглядає розділ хімії, що називається термохімією. Термохімія є складовою частиною хімічної термодинаміки, тому варто звернути увагу на деякі основні поняття термодинаміки.
Сукупність тіл, виділених з простору, утворює систему. Стан системи визначається сукупністю її властивостей і характеризується термодинамічними параметрами: основними – температура Т, тиск – Р, об’єм – V, маса – m, кількість речовини – n (кількість молів) – та додатковими – кількість теплоти і кількість роботи – А. Для термодинамічного опису системи користуються так званими функціями стану. Функції стану – це величини, що залежать від стану і не залежать від шляху, яким система прийшла у даний стан. Функції стану: внутрішня енергія U, ентальпія, ентропія – S, енергія Гіббса – G, енергія Гельмгольца – F з залежать тільки від початкового та кінцевого станів системи. Для успішного освоєння основ хімічної термодинаміки слід уважно розглянути перше начало термодинаміки (Джоуль, 1847 р.), його математичний вираз, та висновки з нього:
Q = ∆U + A = ∆U + p∆V
При ізохорному перебігу хімічного процесу (тобто, ∆V = 0) Q = ∆U, а при ізобарному (∆p = 0): Q = (U + pV2) - (U + pV1) = H2 – H1 = ΔH. Величина H = U + pV має назву ентальпії, або теплоємності системи. В термохімії зміну ентальпії (∆Н) називають теплотою.
Основний закон термохімії був сформульований Г.І.Гессом (1840 р.): тепловий ефект хімічної реакції не залежить від шляху процесу, тобто від числа і характеру проміжних стадій, а залежить тільки від виду (природи) та стану вихідних речовин, та кінцевих продуктів. Інакше кажучи, тепловий ефект реакції дорівнює алгебраїчній сумі теплових ефектів проміжних стадій процесу:
ΔН х.р. = ΣΔНі
Закон Г.І.Гесса має декілька наслідків, але найчастіше використовують такий: тепловий ефект реакції дорівнює сумі теплот утворення (ΔНf) вихідних речовин. Індекс f – перша буква слова formation (утворення, з англ.) Стандартні ентальпії утворення (ΔHутв. або ΔHf,298) є табличними величинами.
Перше начало (перший закон) термодинаміки дозволяє розрахувати тепловий ефект хімічного процесу (нижче наведені приклади таких розрахунків), але не виявляє можливість здійснення цього процесу. На можливість здійснення хімічної реакції вказує друге начало термодинаміки. Стійкість будь-якої системи, зокрема хімічної, визначається співвідношенням двох факторів, або двох тенденцій. З одного боку, будь-яка система прагне до упорядкування, агрегації частинок, тобто їх об’єднання і, як наслідок, до зменшення запасу внутрішньої енергії системи, а з іншого – система прагне до подрібнення, зростання невпорядкованості, бо такий стан термодинамічно більш ймовірний. Мірою невпорядкованості стану системи є ентропія (S)
S = k·lnW
де k = R/NA =1,38·10-23 Дж/К – стала Больцмана, яка дорівнює відношенню універсальної газової сталої R до числа Авогадро NA , W – ймовірність стану. Ентропія має розмірність Дж/моль·К. Це дуже важлива термодинамічна функція, яка дає змогу передбачити самовільне здійснення хімічного процесу, тобто процесу, можливого без дії зовнішних сил. Згідно з другим началом термодинаміки, в ізольованій системі самовільні процеси перебігають у напрямку зростання ентропії. Якщо внаслідок процесу ∆S>0, то процес термодинамічно можливий, а якщо ∆S < 0, то його самовільний перебіг неможливий. Ентропія реакції ∆S визначається співвідношенням, аналогічним виразу для ентальпії реакції ∆Н:
ΔS0х..р. = ΣSºпрод - ΣSºвих.
Добуток Т∆S (Дж/моль або кДж/моль) називають ентальпійним фактором. Для виявлення можливості самовільного перебігу хімічного процесу доцільно ввести таку нову функцію стану, яка врахувала б спільний вплив двох зазначених вище факторів (тенденцій) – ентальпійного (∆Н) і ентропійного (Т∆S). Дж.У.Гіббс (1895 р.) ввів функцію G, яка називається ізобарно-ізотермічним потенціалом (вільна енергія Гіббса). При сталому тиску ∆G = ∆Н - Т∆S. Хімічний процес можливий лише у тому випадку, якщо вільна енергія Гіббса при цьому зменшується (∆G < 0). Збільшення енергії Гіббса (∆G > 0) свідчить про те, що за даних умов процес неможливий. Якщо ∆G = 0, то система перебуває у стані хімічної рівноваги. Як і зміна ентальпії та ентропії системи, зміна енергії Гіббса може бути розрахована за формулою:
ΔG0х.р. = ΔG0f ,прод. – ΔG0f,вих.
Температуру початку реакції легко знайти з співвідношення:
∆Н - Т∆ S < 0 (реакція можлива). Звідки: T > ΔU / ΔS
При умові сталості об’єму (для ізохорних процесів) стан системи може бути описаний аналогічно енергії Гіббса функцією F, яка називається ізохорно – ізотермічним потенціалом, або вільною енергією Гельмгольца:
Δ F = ∆ U - Т∆ S .
Співвідношення між ∆G та ∆F таке ж саме, як між ∆Н та ∆U, тобто вони відрізняються на величину роботи розширення:
∆G - ∆F = p∆V = ∆nRT.
5.2. Приклади розв ¢ язування типових задач
Задача 1. Визначити ентальпію для реакції згоряння метану СН4.
Розв’язок. Запишемо рівняння реакції: СН4 + 2О2 ® СО2 + 2Н2О.
За законом Гесса: DН0х.р. = (DН0СО 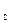 + 2DН0Н
+ 2DН0Н 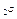 ) – (DН0СН
) – (DН0СН 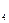 + 2DН0О
+ 2DН0О 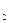 ). З таблиць знаходимо DН0СО
). З таблиць знаходимо DН0СО 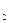 = -393,5 кДж/моль; DН0СН
= -393,5 кДж/моль; DН0СН 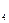 = 74,8 кДж/моль; DН0Н
= 74,8 кДж/моль; DН0Н 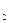 О = -241,8 кДж/моль. Оскільки DН0О
О = -241,8 кДж/моль. Оскільки DН0О 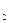 = 0,
= 0,
розраховуємо DН0х.р. = -802,3 кДж.
Задача 2. Скільки теплоти виділиться при згорянні 44,8 л ацетилену С2Н2 ?
Розв’язок: Визначаємо, скільки теплоти виділяється при згорянні 1 моль (22,4 л) ацетилену:
С2Н2 + 5/2 О2 = 2 СО2 + Н2О (г); ΔНх.р. - ?
Згідно з наслідком із закону Гесса, тепловий ефект реакції згоряння ацетилену (ΔНх.р.) дорівнює:
ΔНх.р. = (2ΔНоутв.СО2 + ΔНоутв.Н2О) – (ΔНоутв.С2Н5 + 5/2 ΔНоутв.О2) = 2(-393,5) + (-241,8) – 226,8 – 5/2 (0) = -1255,6 кДж/моль. За умовою задачі, в реакцію вступило 44,8 : 22,4 = 2 моля С2Н2. Таким чином, при згорянні 2 моля ацетилену виділиться 1255,6 2 = 2511,2 кДж теплоти.
Задача 3. Визначити температуру, при якій починається пряма реакція:
С(гр) + Н2О(пара) ® СО(г) + Н2(г) .
Розв’язок: Температуру початку реакції розрахуємо за формулою:
Т = 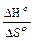 .
.
DН0х.р.= (DН0утв.(СО) + DН0утв.(Н 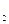 )) - (DН0утв.(С) + DН0утв.(Н
)) - (DН0утв.(С) + DН0утв.(Н 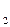 О)) = -110,5 + 241,8 = 131,3 кДж/моль.
О)) = -110,5 + 241,8 = 131,3 кДж/моль.
DS0х.р. = (S0(СО) + S0(Н 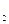 )) - (S0(С) + S0(Н
)) - (S0(С) + S0(Н  О)) = 197,5 + 130,5 - 5,7 - 188,7 = 133,6 Дж/моль×К.
О)) = 197,5 + 130,5 - 5,7 - 188,7 = 133,6 Дж/моль×К.
Тоді: Т = 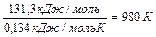 (7070С).
(7070С).
Отже, при температурі вище 980 К стає можливим прямий процес.
5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
5.4. Лабораторна робота
Необхідні прилади, устаткування і реактиви: калориметр, мірні циліндри на 100 мл, мірні колби на 50 мл, 1н. розчини сірчаної кислоти, соляної кислоти, азотної кислоти, оцтової кислоти, гидроксида калію, гидроксида натрію, гидроксида амонію, сухі солі і їх кристалогідрати, сухий нітрат калію, попередньо висушений при 1100С протягом 4 годин.








