4.2. Приклади розв ¢язування типових задач.
Задача 1. Скласти формулу комплексної сполуки, якщо комплексоутворювачем є іон Со3+, лігандами – молекули NH3, а зовнішня сфера утворена іонами Сl-.
Розв’язок. Якщо ступінь окиснення комплексоутворювача 3+, координаційне число, як правило (але не завжди!), буде дорівнювати 6, тобто у внутрішній сфері повинно бути 6 молекул NH3. Тому сполука комплексного іона: [Co(NH3)6].
По алгебраїчній сумі зарядів усіх часток, що входять у комплексний іон, обчислимо заряд комплексного іона. Молекули NH3 не мають заряду, тобто, алгебраїчна сума: 3 + 6×0 = 3+, отже формула комплексного іону - [Co(NH3)6]3+. Щоб молекула комплексної сполуки була нейтральною, у зовнішній сфері повинно бути три іони Сl-. Таким чином, формула комплексної сполуки: [Co(NH3)6]Cl3.
Задача 2. Написати рівняння дисоціації іонів [Ag(NН3)2]+ і [Ag(CN)2]-, а також вираження для констант нестійкості. Порівняти чисельні значення констант нестійкості і вказати, який із приведених іонів більш стійкий.
Розв’язок.
[Ag(NH3)2]+ Û Ag+ + 2NH3 Кн = 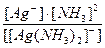 = 6,8×10-8
= 6,8×10-8
[Ag(CN)2]- Û Ag+ + 2СN- Kн = 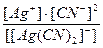 = 1×10-21.
= 1×10-21.
Константа нестійкості другого іона значно менше, отже комплексний іон [Ag(CN)2]- більш стійкий у розчині.
Задача 3. Напишіть у молекулярній і іонній формі рівняння реакції обміну, враховуючи, що утворюється нерозчинна комплексна сполука:
Розв ’язок .
2Na3[Co(CN)6] + 3FeCl2 ® Fe3[Co(CN)6]2¯ + 6NaCl;
2[Co(CN)6]3- + 3Fe2+ ® Fe3[Co(CN)6]2¯.
4.3. Задачі для самостійного рішення: 720, 724, 736
4.4. Лабораторна робота
Необхідні прилади, устаткування і реактиви: насос Комовського, лійка Бюхнера, штатив із пробірками, кристалізатор з льодом, розчини солей металів: Cu2+, Ag+, Ni2+, Co2+, Zn2+, Cd2+, AlCl3, ZnCl2, PbAc2, SnCl2 ; натрій і амоній гідроксидів, безводні солі: CuCl2, CuSO4, NiSO4, CoCl2; етанол, розчини натрій сульфіду, концентрованої нітратної (азотної) кислоти, етиленгліколю, гліцерину, глікоколу, K4[Fe(CN)6] , K3[Fe(CN)6], FeSO4, FeCl3 , AgNO3 .
Дослід 1. Одержання і дослідження амміакатів
а) одержання аміакатів d-металів
До розчину солі відповідного іона металу (Cu2+, Ag+, Ni2+, Co2+, Zn2+, Cd2+ - завдання дає викладач) додають невелику кількість розчину лугу. Осади гідроксидів, що утворилися, розчиняють у надлишку водного розчину NH3.
Необхідно:
- відзначити колір розчинів комплексів;
- написати схему утворення комплексних іонів;
- указати тип гібридизації атомних орбіталей центральних атомів і форму координаційних поліедрів (просторову структуру) комплексних іонів;
- знайти по таблицях константи нестійкості для кожного комплексного іона і зробити висновок про їхню міцність.
б) виділення і дослідження аміаката міді (елементи НДРС)
До 2-3 мл концентрованого розчину солі купруму (міді) (2+) додають невелику кількість концентрованого розчину NH3 до повного розчинення осаду, що спочатку випав. До розчину, що утворився, доливають рівну кількість етанолу, перемішують і залишають кристалізуватися на 10-15 хвилин у кристалізаторі з льодом. Кристали, що випали, фільтрують на лійці Бюхнера, промивають їх спочатку сумішшю NH3 - спирт (1:1), а потім сумішшю етанол – ефір (1:1). Висушують кристали на фільтрі під вакуумом, використовуючи насос Комовського.
Проводять аналіз отриманого комплексу. Для цього поміщають невелику кількість кристалів аміакату в 3 сухі пробірки:
- першу пробірку нагрівають на полум'ї пальника: аміак, що виділяється, визначають по запаху і по зміні кольору вологого індикаторного папера;
- комплексну сполуку в другій пробірці розчиняють у дистильованій воді і доливають розчин Na2S; спостереження і рівняння реакції записують у журнал;
- у третю пробірку доливають 2 мл води, а потім до отриманого розчину додають розчин концентрованої азотної кислоти; відзначають зміну кольору розчину. Роблять висновки про міцність комплексної сполуки, приводять відповідне рівняння реакції.
в) виділення аміакату нікелю (елементи НДРС)
До 2-3 мл розчину солі нікелю (2+) додають невелику кількість концентрованого розчину NH3 до повного розчинення осаду, що спочатку випав. Розчин фільтрують. Для повноти осадження до фільтрату додають аміачний розчин хлориду амонію (NH3 – NH4Cl = 1:1). Осад, що випав, промивають декантацією 2-3 рази аміачним розчином хлориду амонію, а потім послідовно спиртовим розчином амоніаку і чистим спиртом. Висушують кристали на фільтрі під вакуумом, використовуючи насос Комовського. Аналізують комплекс аналогічно досліду 1б.
г) виділення аміакату кобальту (елементи НДРС)
До 2-3 мл розчину солі кобальту (2+) додають невелику кількість концентрованого розчину NH3 до повного розчинення осаду, що спочатку випав. Розчин фільтрують від можливого осаду. До гарячого розчину додають спирт до помутніння і залишають кристалізуватися на 10-15 хвилин у кристалізаторі з льодом. Кристали, що випали, фільтрують на лійці Бюхнера, промивають їх спочатку сумішшю NH3 - спирт (1:1), а потім холодним спиртом. Висушують кристали на фільтрі під вакуумом, використовуючи насос Комовського. Аналізують комплекс аналогічно досліду 1б.
Дослід 2. Одержання гідроксокомплексів
До розчину заданої солі (СrСl3, AlCl3, ZnCl2, PbAc2, SnCl2) додають спочатку недолік, а потім надлишок розчину NaOH. Записують спостереження і рівняння реакцій, що відбуваються, у молекулярній і іонній формі, а також рівняння зовнішньосферної дисоціації.
У висновках укажіть:
- Яка речовина утворюється при додаванні недоліку NaOH?
- Який характер кислотно-основних властивостей цієї сполуки (кислотний, основний, амфотерний)?
- До якого типу (катіонного, аніонного) належить комплексний іон, що утворився при додаванні надлишку лугу?
- На підставі значень Кн роблять висновок про стійкість комплексних іонів.








