Необхідні прилади , устаткування і реактиви : штативи з пробірками, розчини плюмбум нітрату чи ацетату, натрій сульфіду і йодиду, бромна вода, залізна, магнієва, цинкова стружка.
Дослід 1. Електронна структура атомів і одноатомних іонів
При окисненні атомів металів число електронів в електронній оболонці зменшується й утворюються іони з позитивним зарядом.
Наприклад: 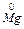 – 2e ® Mg2+
– 2e ® Mg2+
… 3s2 …3s0
У три пробірки (на1/3 об¢єму) наливають розчин плюмбум нітрату (нітрату свинцю) Рb(NO3)2 чи плюмбум ацетату PbAc2. У першу пробірку опускають залізо, у другу – цинк, у третю – магній. Через кілька хвилин оглядають поверхню металів, опущених у розчин солі свинцю. Описують свої спостереження.
Необхідно:
- скласти рівняння реакцій, що пройшли між залізом, магнієм і цинком із сіллю плюмбуму(2+);
- привести електронно-графічні формули Fe, Mg, Zn, Pb2+ до реакції і тих же елементів після реакції;
- знайти в періодичній системі електронні аналоги плюмбуму і записати скорочені формули, що виражають електронну структуру атомів цих елементів.
Дослід 2. Електронна структура атомів і одноатомних іонів неметалів (Дослід виконується під тягою !) .
При відновленні атомів неметалів число електронів в електронній оболонці зростає й утворюються іони з негативним зарядом.
Наприклад: 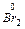 + 2e ® 2Br-
+ 2e ® 2Br-
4s24p5 4s24p6
У дві пробірки наливають по ~1 мл розчинів натрій сульфіду і йодиду і додають у кожну пробірку по 1-
2 мл бромної води.
Необхідно:
- скласти рівняння реакцій і описати свої спостереження;
- привести електронно-графічні формули S2-, I-, Br0 до реакції і тих же елементів після реакції.
У висновках укажіть:
- значення квантових чисел (головного, орбітального, магнітного, сумарного спіна), що характеризують валентні електрони атомів і іонів, які утворюються в результаті реакцій.
3.5. Список рекомендованої літератури
1. Фролов В.В. Химия. – М.: Высш. шк., 1986. – С.20-67.
2. Глинка Н.Л. Общая химия – Л.: Химия, 1988. – С.55-108; 2004. – С. 37-96.
3. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 1981.-С.7-40 (2001.– С.6 – 45).
4. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 39-51.
5. Пилипенко А.Г., Починок В.Я., Середа И.П. и др.Справочник по елементарной химии. – Киев.: Наук. думка, 1985. – С. 50-93.
6. Сухан В.І., Табенська Т.В., Капустян А.Й., Горлач В.Ф. Посібник для вступників до вищих навч. закладів. – Київ.: Либідь, 1996. – С.53-85.
7. Кириченко В.І. Загальна хімія: Навч. посіб. – К.: Вища шк., 2005. – С. 21– 59.








