У квантовомеханічній моделі атома енергетичний стан електрона описується набором з чотирьох квантових чисел.
1. Головне квантове число n – міра енергії електрона в атомі, розмір електронної хмари. Приймає значення: n = 1,2,3,4,…..., 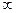 .
.
2. Орбітальне квантове число l – момент кількості руху електрона на орбіталі, форма електронної хмари. Приймає значення l = 0,1,2,3,... ( n-1). Чисельним значенням ставляться у відповідність букви: s, p, d, f – з латинського алфавіту.
3. Магнітне квантове число ml – визначає орієнтацію електронної хмари у магнітному полі ядра на данному енергетичному підрівні. Приймає значення: ml = - l, (1- l),…0,  …( l-1), l. Для кожного l максимально можливі (2 l+1) значень ml , а для кожного n максимально можливі n2 значень ml : s-орбіталь має одну орієнтацію в просторі (ml=0), p-орбіталі – три (ml=-1,0,1), розташовані уздовж осей х, y, z у декартовой системі координат (px, py, pz), d-орбіталі – п'ять (ml = -2, -1, 0, 1, 2), розташовані уздовж бісектрис у декартових площинах (dxy, dyz, dzx,) і на осях у тих же площинах (d
…( l-1), l. Для кожного l максимально можливі (2 l+1) значень ml , а для кожного n максимально можливі n2 значень ml : s-орбіталь має одну орієнтацію в просторі (ml=0), p-орбіталі – три (ml=-1,0,1), розташовані уздовж осей х, y, z у декартовой системі координат (px, py, pz), d-орбіталі – п'ять (ml = -2, -1, 0, 1, 2), розташовані уздовж бісектрис у декартових площинах (dxy, dyz, dzx,) і на осях у тих же площинах (d 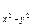 , d
, d 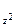 ).
).
4. Спінове квантове число ms – момент власної кількості руху електрона; може приймати значення +1/2 і –1/2. Це квантове число не зв'язане з іншими трьома, тобто не є наслідком рішення рівняння Шредингера. Умовно спін електрона прийнято позначати стрілкою чи ¯.
Електрони з однаковим значенням головного квантового числа n утворюють квантовий шар близьких по розмірах хмар. Квантові рівні побудовані з підрівнів, що поєднують електрони з однаковим значенням орбітального квантового числа l. Підрівні складені з орбіталей: на кожній орбіталі можуть знаходитися максимум два електрони (із протилежними спінами). Максимальна електронна ємність рівня дорівнює 2n2 , а підрівня 2(2l+1).
Якщо дано три квантових числа n , l , m e, то тим самим визначено і хвильову функцію електрона – атомну орбіталь іноді зображують як енергетичну комірку (“квантову комірку”) у вигляді квадрата .
Для s - електронів може бути лише одна орбіталь, або одна енергетична комірка .
Для р - електронів – три .
Для d – електронів – п’ять .
Для f – електронів – сім .
При заповненні орбіталей електронами в складних атомах варто враховувати три правила:
1.Правило мінімальних енергій: електрони заповнюють орбіталі в міру зростання енергії останніх. Величину енергії визначають за двома правилами Клечковского: із збільшенням заряду ядра атома послідовне заповнення електронних орбіталей відбувається від орбіталей з меншим значенням суми головного і орбітального квантових чисел (n = l) до орбіталей з більшим значенням цієї суми (перше правило). За однакових значень суми (n = l) заповнення орбіталей відбувається послідовно у напрямку зростання головного квантового числа n (друге правило).
2. Принцип заборони Паул і: в атомі не може бути двох електронів з однаковим набором чотирьох квантових чисел. Це положення наглядно можна проілюструвати на прикладі елемента 2Не: перший електрон характеризується квантовими числами n = 1, l = 0, ml = 0, ms = +1/2 ; для другого електрона три перші квантові числа співпадають, але четверте (спінове) має значення -1/2, тобто відрізняється за знаком.
3. Правило Хунда: електронна система незбудженого атома в межі підрівня прагне до максимального сумарного спину, тобто в межах підрівня сума спінових чисел повинна бути максимальна. Наприклад, для елемента 6С на 2р-підрівні сумарний спін буде максимальним лише у випадку: 6С ↑ ↑ ↑ .
Існують два умовних способи зображення заселеності електронних оболонок атомів: у вигляді електронних формул і у формі квантових комірок.
Наприклад:
1) 11Na 1s²2s²2р63s¹ або [Ne]3s¹ .
2) 11Na ↑ .
Необхідно звернути увагу на те, що періодична система елементів побудована відповідно до періодичного закону Д.І. Менделєєва, сучасне формулювання якого: фізичні і хімічні властивості елементів і їхніх сполук знаходяться в періодичній залежності від заряду ядра.








