Т е м а 3. Будова атома. Періодичний закон. Властивості елементів
3.1.Рекомендації до вивчення теоретичного матеріалу
При вивченні даної теми варто звернути увагу на ряд понять і положень, які вимагають абстрактного сприйняття. До кінця ХІХ ст. в хімії панувало уявлення про неподільність атома (атомос – з грецького, неподільний). Але досліди Крукса і Перрена (1880-1885рр.) щодо катодного випромінювання, визначення природи явища термо- і фотоелектронної емісії, і особливо відкриття самовільного (спонтанного) радіоактивного розпаду ядер важких елементів А. Беккерелем (1896р), наявно свідчили про складну природу атомів. У цей же період були відкриті і охарактеризовані дві менші ніж атом елементарні частини – електрон (у 1891 р. Дж.Стоней запропонував термін “електрон”) і протон (Дж. Томсон і В.Він – 1896 р.). Третя елементарна частина – нейтрон, була відкрита Дж. Чедвіком (1932 р.) при вивченні ядерних реакцій.
Маса електрона дорівнює 9,1094·10-31 кг, що становить приблизно 1/1840 маси атома водню; розмір електрона 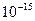 м. Заряд електрона ( Р. Маллікен, 1909 р.) дорівнює 1,6021·
м. Заряд електрона ( Р. Маллікен, 1909 р.) дорівнює 1,6021· 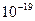 Кл; його величину прийнято за одиницю заряда (тобто, –1). Маса спокою протона 1,6725 ·
Кл; його величину прийнято за одиницю заряда (тобто, –1). Маса спокою протона 1,6725 · 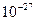 кг (або 1,00727 а.о.м.), заряд протона позитивний і має значення +1. Нейтрон – стабільна елементарна частина з масою спокою 1,6747 ·
кг (або 1,00727 а.о.м.), заряд протона позитивний і має значення +1. Нейтрон – стабільна елементарна частина з масою спокою 1,6747 · 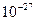 кг (або 1, 008665 а.о.м.), без електричного заряду.
кг (або 1, 008665 а.о.м.), без електричного заряду.
Варто зазначити, що на сьогоднішній день відкрито понад 100 елементарних частинок. Найменшими частинками є кварки, носії часткових зарядів (u – кварки мають заряд + ⅔, а d-кварки мають заряд - ⅓). Вважається, що протон складається з трьох кварків в сполученні uud, а нейтрон - результат комбінації udd. Передбачається, що кварки складаються з ще менших частинок –прокварків (преонів, рішонів).
Формування сучасної теорії будови атому відбувалося поетапно. У 1911 р. Е.Резерфорд експериментально довів наявність ядер у атомів і запропонував планетарну (ядерну) модель атома, а згодом у 1913 р. датським фізиком Н. Бором була розроблена теорія будови атома водню, яка виходила з моделі Е. Резерфорда і учення А.Ейнштейна (1905р). Положення теорії Н.Бора розглянуті у всіх підручниках. Зазначимо лише, що теорія Н.Бора, незважаючи на недоліки, дала змогу теоретично обчислити швидкість руху електрона на стаціонарних кругових орбітах, енергію орбіт та їхні радіуси. Радіуси стаціонарних орбіт, за Н. Бором, можна обчислити за формулою: rn = 0,529 · 10-10 n² м. Величина 0,529Å (1Å = 1 Ангстрем = 1010 м), або 0,0529 нм (1 нм = 1 нанометр = 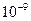 м) є найменшою (n = 1) і називається Боровським радіусом.
м) є найменшою (n = 1) і називається Боровським радіусом.
Швидкість руху електрона на кругових орбітах, за Н.Бором, має значення υ n = 2,167· 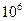 ·
· 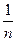 м/c, а енергія Е n = -13,6 ·
м/c, а енергія Е n = -13,6 · 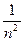 еВ (електронвольт). Присутня у всіх формулах величина n була названа головним квантовим числом, вона приймає значення від 1 до нескінченності.
еВ (електронвольт). Присутня у всіх формулах величина n була названа головним квантовим числом, вона приймає значення від 1 до нескінченності.
У 1924 р. французький фізик Луї де Бройль зробив припущення про двоїсту корпускулярно-хвильову природу будь-яких рухомих матеріальних частинок і вивів рівняння хвильової механіки:
λ = h/( mυ ),
де λ – довжина хвилі, m – маса частинки, υ – швидкість її руху, h – стала М.Планка. Отже, будь-яка елементарна частинка, безумовно, матеріальна (тобто, є корпускулою з певною масою спокою), але її рух має хвильову природу.
У 1925 р. В.Гейзенберг запропонував принцип невизначеності: в масштабах атомів неможливо з математичною точністю виявити траєкторію руху мікрочастинки, а отже її швидкість, точне місце перебування (її координати) та її кількість руху (імпульс р = mυ). Можна говорити лише про ймовірність перебування елементарних мікрочастинок у певних точках простору (зокрема перебування електрона в атомному просторі). Як модель стану електрона в атомі у квантовій механіці було прийнято уявлення про електронну хмару (а не Боровські кругові орбіти), частина відповідних ділянок якої пропорційна ймовірності перебування там електрона. Найчастіше електронну хмару зображують у вигляді граничної поверхні, яка охоплює 90 % заряду і маси.
У 1927 р. Е. Шредінгер запропонував хвильове рівняння – основне рівняння квантової механіки:
ĤΨ n = EnΨ ,
у якому квадрат хвильової функції (|Ψ|²) (“псі” квадрат) характеризує ймовірність (точніше, густину ймовірності) виявлення електрона на визначених відстанях від ядра. Хвильове рівняння Шредінгера є диференціальним рівнянням другого порядку у частинних похідних. У нього три невідомих – Ψ, E, V. Знайти їх можна при сумісному розв’язанні його з двома іншими рівняннями:
а) для потенціальної енергії,
б) для граничних умов: Ψ = 0, якщо r → ∞.
Наслідком розв’язку рівняння Е.Шредінгера для атома гідрогену є 3 квантові числа (n , l i ml), що характеризують атомну орбіталь. Орбіталь– область простору, у якій імовірність перебування електрона становить 90%. У якості моделі стан електрона у атомі прийнято зображувати у вигляді електронної хмари, густина відповідних ділянок якої пропорційна ймовірності знаходження там електрона. Можливі форми електронних хмар у атомі показані на малюнку (рис. 2). Зверніть увагу, що орбіталь описується хвильовою функцією, яка може мати як позитивне, так і негативне значення. При переході від атома водню до багатоелектронних атомів форми s -, p -, d-, f-орбіталі якісно залишаються тими самими, їх вважають приблизно такими ж, як у збудженому атомі водню. Але для точних квантовохімічних розрахунків користуються методом послідовних наближень, який детально розглядається в спецкурсі квантової хімії.








